
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Libere o poder do TR-FRET para ensaios altamente sensíveis e homogêneos na descoberta de medicamentos, interações biomoleculares e pesquisa celular.
A FRET resolvida no tempo (TR-FRET) é uma tecnologia de detecção que combinaa fluorescência resolvida no tempo (TRF) com atransferência de energia de ressonância de Förster (FRET). A TR-FRET é usada principalmente para analisar eventos de ligação e para triagem de medicamentos de alto rendimento.
A transferência de energia de ressonância de Förster descreve uma transferência de energia entre dois fluoróforos. Seu nome é uma homenagem ao cientista alemão Theodor Förster, que originalmente desenvolveu a teoria da transferência de energia de ressonância.1 Para queela ocorra, um fluoróforo doador que absorveu energia após a excitação e se encontra em um estado eletronicamente excitado transfere energia para um segundo fluoróforo aceitador. A transferência de energia reduz a intensidade de emissão do doador e aumenta a intensidade de emissão do aceitador.
A transferência de energia depende de duas condições. Em primeiro lugar, a proximidade espacial entre o doador e o aceitador deve estar na faixa de 20 a 90 Å. A transferência de energia de ressonância é inversamente proporcional à sexta potência da distância entre o doador e o aceitador e, portanto, é muito sensível às mudanças de distância. Em segundo lugar, é necessária uma sobreposição entre o espectro de emissão do doador e o espectro de excitação do aceitador. Os "pares FRET" requerem distância suficiente nos picos de emissão para serem opticamente distinguíveis, mas, ao mesmo tempo, sobreposição espectral suficiente para permitir uma transferência de energia eficiente (fig. 1A).
Na biologia, as proteínas fluorescentes codificadas geneticamente são usadas com mais frequência. As mais populares incluem a Proteína Fluorescente Verde (GFP), a Proteína Fluorescente Vermelha (RFP), a Proteína Fluorescente Ciano (CFP) e a Proteína Fluorescente Amarela (YFP).2
A FRET é geralmente usada para estudar interações moleculares ou eventos de ligação e pode ser empregada para determinar a afinidade de ligação dedois parceiros de ligação. Eles são avaliados ligando cada parceiro de ligação a ser investigado a um fluoróforo e detectando o nível de transferência de energia que está ocorrendo (fig. 1 B, C). No entanto, como o FRET padrão é afetado negativamente pelo ruído de fundo derivado da luz de excitação dispersa e da autofluorescência, dificilmente é possível obter medições altamente sensíveis com essa abordagem.
O FRET resolvido no tempo elimina o ruído de fundo de curta duração derivado da luz de excitação dispersa e da autofluorescência, graças à adoção da fluorescência resolvida no tempo e à introdução de uma detecção com atraso no tempo. Isso é possível graças ao uso de lantanídeos como doadores. Esses fluoróforos têm grandes deslocamentos de Stokes e tempos de vida de emissão de até milissegundos.
O TR-FRET se baseia na transferência de energia de ressonância que ocorre entre um lantanídeo e um fluoróforo de vida curta, quando estão muito próximos. Devido a essas propriedades, ele tem estabilidade e especificidade aprimoradas em relação ao FRET padrão. A interferência do tampão ou do meio é significativamente reduzida pela fluorescência de longa duração e pela detecção ratiométrica dos dois comprimentos de onda de emissão do doador e do aceitador.
O princípio geral de como essa tecnologia é aplicada é muito semelhante em todos os diferentes fabricantes de kits, sendo que os mais populares incluem HTRF®, LANCE®,LanthaScreenTM e THUNDERTM. O doador e o aceitador são ligados covalentemente aos parceiros de interação ou um anticorpo específico contra cada um dos dois alvos (ou tags) é marcado com o doador ou o aceitador. Ao estimular o doador, a energia será transferida para o aceitador, que emitirá devido à transferência de energia de ressonância de fluorescência, se os alvos estiverem muito próximos. A saída é proporcional à quantidade de ligação que está ocorrendo.
No TR-FRET, são usados diferentes fluoróforos, formando diferentes pares, dependendo do fabricante.
Os lantanídeos são normalmente excitados em 320 - 340 nm. A emissão de európio é geralmente detectada em 620 nm, enquanto a de térbio pode ser detectada em 490 ou 620 nm, dependendo do kit e do fabricante. Para os aceitadores, a emissão é de 520 nm para fluoróforos verdes ou 665 nm para os vermelhos. A emissão do doador é usada como referência interna, enquanto a emissão do aceitador é um indicador da transferência de energia (evento de ligação) que está ocorrendo (fig. 3).
Entre a excitação e a detecção de fluorescência, é aplicado um atraso de tempo na faixa de microssegundos. Isso elimina a fluorescência de fundo não específica de curta duração. Em seguida, a emissão é geralmente detectada em um período de tempo (janela de medição) de microssegundos (fig. 4). Dependendo do kit e do fabricante, as configurações de atraso de tempo e janela de medição podem ser diferentes.
Em seguida, é calculada uma proporção dos sinais integrados ao longo do tempo dos dois canais de emissão. Essa medição ratiométrica normaliza o sinal, elimina a interferência do meio e a atenuação e corrige os erros de manuseio do líquido ou a variabilidade de poço para poço.
A sensibilidade e a versatilidade tornaram os ensaios TR-FRET amplamente populares. A combinação da detecção resolvida no tempo e das medições raciométricas aumenta significativamente a janela do ensaio e reduz o fundo. Além disso, a emissão de lantanídeos dificilmente clareia, é estável ao longo do tempo e é compatível com diferentes reagentes e condições experimentais.
Apesar desses benefícios, a principal vantagem desse método é provavelmente o fato de que a detecção do par ligado não exige a separação física dos componentes não ligados para reduzir o fundo. Como o chamado ensaio homogêneo, o TR-FRET não precisa de etapas de lavagem intermediárias e pode ser executado como um simples ensaio de adição e leitura (fig. 5), minimizando as etapas de manuseio e sendo mais conveniente e menos demorado do queos ELISAs. Consequentemente, ele é particularmente adequado para campanhas de triagem HTS automatizadas.
No entanto, a extinção do sinal gerada por interações externas com o processo de excitação intramolecular ou a fluorescência dos compostos da biblioteca ou das proteínas biológicas pode ser uma limitação.3
Os kits de ensaio TR-FRET estão disponíveis em diferentes fabricantes. Embora todos os ensaios sejam baseados em uma tecnologia comum e possam ser detectados em um leitor de microplacas, existem diferenças entre os kits e os fabricantes. Essas diferenças estão relacionadas principalmente a diferentes tipos de doadores e aceitadores, suas combinações e diferentes tempos de início de detecção e janela de medição.
Todas as tecnologias de ensaio e seus recursos, incluindo os picos de excitação e emissão, estão resumidos na tabela 1. Além das características descritas, esses kits também variam em seus tempos de intervalo e janelas de ensaio.
Tabela 1: comparação dos kits de ensaio TR-FRET mais populares e seus picos de excitação e emissão
| Kit | Doador | Tipo de gaiola | Excitação | Emissão | Aceitador | Emissão |
| LANCE | Európio | Quelato | 320 nm | 620 nm | ULightTM | 665 nm |
| LANCE | Európio | Quelato | 320 nm | 620 nm | Surelight® APC | 665 nm |
| LanthaScreen Eu | Európio | Quelato | 320 nm | 620 nm | AlexaFluor 647 | 665 nm |
| LanthaScreen Tb | Térbio | Quelato | 340 nm | 490 nm | Fluoresceína/GFP | 520 nm |
| Vermelho HTRF (Eu) | Európio | Criptato | 320 nm | 620 nm | XL665/d2 | 665 nm |
| Vermelho HTRF (Tb) | Térbio | Criptato | 340 nm | 620 nm | XL665/d2 | 665 nm |
| Verde HTRF (Tb) | Térbio | Criptato | 340 nm | 620 nm | Fluoresceína/GFP | 520 nm |
| Transcreener TR-FRET | Térbio | Quelato de térbio | 340 nm | 620 nm | HiLyte647 | 665 nm |
| THUNDER | Quelato | de európio | 320 nm | 620 nm | Corante vermelho distante | 665 nm |
Além do uso de kits disponíveis comercialmente, os pares de doadores e aceitadores TR-FRET também podem ser combinados livremente, desde que o espectro de emissão do doador apresente sobreposição suficiente com o espectro de excitação do aceitador, conforme mostrado no AN 388: Differential binding of ∆9-tetrahydrocannabinol derivatives to type 1 cannabinoid receptors (CB1).
A detecção FRET resolvida no tempo é realizada predominantemente em leitores de microplacas. A configuração básica de um leitor de placas TR-FRET consiste em uma fonte de luz, filtros de excitação e emissão para seleção de comprimento de onda e um detector de tubo fotomultiplicador (PMT). Além do modo de detecção TRF, os leitores de placas devem ser capazes de medir dois canais de emissão em uma única execução, sequencial ou simultaneamente. Como o TR-FRET é usado principalmente na triagem de alto rendimento, a compatibilidade com microplacas de 384 e 1536 poços é geralmente obrigatória.
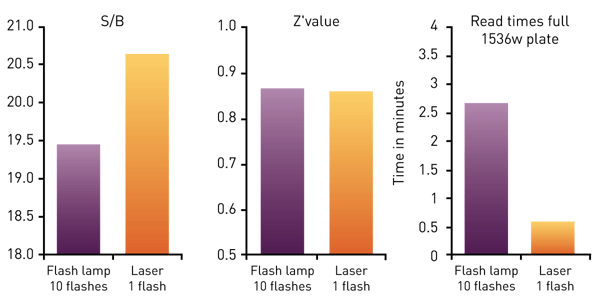
Os complexos de quelato ou criptato são normalmente excitados em 320 a 340 nm. Portanto, tanto uma lâmpada de xenônio quanto um laser de excitação específico podem ser usados como fonte de luz. Um laser TRF concentra mais energia nessa faixa específica de comprimento de onda e leva a melhores resultados com melhor discriminação entre sinais baixos e altos.
O PHERAstar FSX é equipado com um laser TRF com uma frequência de flash de 60 Hertz, proporcionando uma vantagem significativa de velocidade para a detecção TR-FRET. O laser permite a medição de uma placa completa de 1536 poços em 36 segundos, mantendo um Z' > 0,8 para ensaios celulares e bioquímicos (fig. 7), conforme mostrado na nota de aplicação "Cellular and biochemical HTRF assays measured in 1536-well microplates" (Ensaios celulares e bioquímicos HTRF medidos em microplacas de 1536 poços).
Na nota de aplicação Excellent assay performance of THUNDER™ TR-FRET cell-based cytokine assays performed on the PHERAstar FSX, é mostrado como o PHERAstar FSX com laser TRF apresenta sensibilidade e faixa dinâmica muito maiores do que uma leitora de microplacas HTS concorrente.
A PHERAstarFSX é equipada com detectores de contagem de fótons (PMTs) para detecção TR-FRET. Os detectores comuns fornecem como saída um valor de integração para a área sob a curva durante o tempo de integração. Em vez disso, os PMTs de contagem de fótons contam cada fóton individual e, assim, monitoram toda a curva de decaimento de lantanídeos.
No leitor PHERAstar FSX, a detecção de contagem de fótons permite a medição e a exibição da curva de decaimento da emissão com uma resolução de tempo de 2 microssegundos. Esse recurso exclusivo, chamado de Decay Curve Monitoring, simplifica o desenvolvimento de ensaios e ajuda a otimizar os parâmetros de tempo, melhorando a detecção e reduzindo o fundo. Juntamente com o Integration Wizard, o Decay Curve Monitoring oferece uma plataforma para a otimização do ensaio TR-FRET.
A detecção dos dois comprimentos de onda de emissão é necessária, seja sequencial ou simultaneamente. Em geral, os leitores de microplacas medem as duas emissões uma após a outra. Entretanto, a detecção simultânea tem várias vantagens.
O sistema de detecção de Emissão Dupla Simultânea (SDE) no PHERAstarFSX usa dois PMTs combinados para a medição paralela dos dois comprimentos de onda de emissão. Dessa forma, o SDE reduz os tempos de leitura pela metade e aumenta o rendimento, ao mesmo tempo em que corrige as variações causadas por diferenças de volume de preenchimento, concentrações ou flutuações na energia de excitação. Esses recursos resultam em maior sensibilidade e menores %CVs. As medições de canal único da SDE são combinadas para o cálculo ratiométrico dos resultados de ambos os canais de emissão.
Na triagem de medicamentos, o downscaling do ensaio é uma etapa fundamental. A miniaturização visa reduzir os volumes de amostra e, ao mesmo tempo, manter a reprodutibilidade, a confiabilidade e a robustez do ensaio. Os ensaios podem ser reduzidos para placas de 3456 poços - os formatos de 384 e 1536 poços são os mais comuns.
Os ensaios TR-FRET podem ser miniaturizados e, ao mesmo tempo, manter a precisão e a reprodutibilidade, pois a intensidade do sinal não depende da quantidade de um traçador, mas de sua concentração. Isso é apoiado ainda mais pelo uso de um leitor de placas altamente sensível, como o PHERAstarFSX.
Na palestra científica "Ensaios de triagem de downscaling bem-sucedidos: Servier's experience", apresentamos um estudo de caso em que o leitor de placas PHERAstarFSX contribuiu significativamente para a miniaturização de um ensaio HTRF do formato de 384 para 1536 poços. No PHERAstarFSX, a miniaturização foi combinada com a diluição adicional de reagentes e com a detecção "on-the-fly" (apenas um flash por poço). Isso resultou em valores Z' de alta qualidade e em uma redução significativa no uso de reagentes e no consumo de tempo.

O TR-FRET é usado para analisar eventos de ligação em ensaios bioquímicos. Além disso, é adequado para ensaios baseados em células, uma vez que as medições de lisados de células podem ser realizadas na presença de um meio de cultura (detecção homogênea).
As diferentes configurações biológicas inclueminterações proteína-DNA/RNA, ligação proteína-proteína (ligante-receptor), quinases e vias de sinalização, incluindo GPCRs, citocinas e biomarcadores.
O TR-FRET é particularmente popular na comunidade de triagem de medicamentos devido à sua sensibilidade, maior rendimento, confiabilidade e flexibilidade, e menos resultados falso-positivos ou falso-negativos.
As interações moleculares entre proteínas e entre proteínas e ácidos nucleicos ocorrem em todos os níveis de uma célula. Essas interações incluem epigenética (por exemplo,atividade modificadora de histonas, onde podem ser usadas para investigar a inibição de histona desacetilases), transdução de sinais (por exemplo, ativação de proteína G), comunicação celular (por exemplo, interação ligante-receptor), regulação de genes etc. As interações proteína-proteína também desempenham um papel fundamental na forma como funcionam as PROteolysis TArgeting Chimeras (PROTACs) ou colas moleculares, pequenas moléculas que direcionam seletivamente as proteínas indesejadas para o sistema de eliminação de proteínas da célula (sistema ubiquitina-proteassoma). Os pesquisadores podem escolher entre diferentes opções para ensaios de degradação de proteínas com base em células. Para a degradação direcionada de proteínas por PROTACs e colas moleculares, técnicas como AlphaScreen®, Transferência de Energia de Ressonância de Fluorescência Resolvida no Tempo (TR-FRET) ou métodos de luminescência como NanoBRET™ podem ser realizados em microplacas para medir a interação entre o alvo e a ligase. Essas técnicas também podem ser usadas para estudar a degradação de proteínas direcionadas decorrente de interações específicas entre degrons e ligases conhecidos.
Neste depoimento, Nick Bland, da empresa Domainex, discute como o PHERAstar FSX apoia sua pesquisa bioquímica com valores Z` de 0,9 em campanhas baseadas em HTS TR-FRET.

A atividade da quinase é analisada principalmente com ensaios sanduíche que medem a alteração da fosforilação de um substrato, conforme mostrado na nota de aplicaçãoAnálise da fosforilação de ERK1/2, p38αβγ e STAT3 com os imunoensaios de quinase celular THUNDER™ TR-FRET. Os ensaios de competição também podem ser empregados para monitorar diferentes produtos gerados pela reação (por exemplo, ADP). Como alternativa, utiliza-se um substrato de quinase marcado com fluorescência e um anticorpo anti-fosfocinase marcado com lantanídeos (fig. 8), conforme mostrado na nota de aplicação "LanthaScreen TR-FRET tyrosine kinase and protein kinase C assay". Esses métodos também podem ser aplicados a proteases e ubiquitinação. Para obter mais informações sobre a detecção da atividade da quinase, visite nossa postagem no blog "Kinase assays".
Os ensaios para estudaros receptores acoplados à proteína G (GPCRs) podem ser mecanicistas ou funcionais. Os ensaios funcionais concentram-se principalmente na quantificação de mensageiros secundários (por exemplo, IP1 ou AMPc), pois eles podem se acumular na célula como consequência da atividade de inibidores específicos. Dessa forma, os segundos mensageiros são usados como leitura, pois sua concentração está correlacionada com a ligação do ligante e o envolvimento do receptor. Isso é mostrado nas notas de aplicação "HTRF IP-One assay used for functional screening" e "GPCR activation is measured using Cisbio's cAMP and IP1 HTRF HTplex cell-based assay". Os ensaios mecanicistas se concentram na organização e oligomerização do receptor na membrana celular para mediar a sinalização.
A análise de produtos de sinalização downstream pode ser usada para identificar vias aberrantes, possivelmente desempenhando um papel em doenças neurológicas, metabólicas e inflamatórias. O FRET com resolução de tempo pode ser usado para testar a eficácia de compostos que visam especificamente a essas doenças. Os exemplos de aplicação incluem "Desenvolvimento de um ensaio rápido de insulina HTRF" para doenças metabólicas, em particular diabetes mellitus, "Detecção da agregação da proteína tau humana" emdoenças neurodegenerativas eExcelente desempenho do ensaio de citocinas baseado em células THUNDER™ TR-FRET realizado no PHERAstar FSX para quantificação de citocinas em diferentes doenças.
Na palestra científica Targeting the type 1 cholecystokinin receptor to screen for novel obesity treatments, é discutido como um ensaio TR-FRET foi usado para rastrear o acúmulo de monofosfato de inositol, um metabólito a jusante do IP3. Com base nesses resultados, foi desenvolvido um outro ensaio de ligação baseado em TR-FRET.

Devido às dificuldades técnicas e ao rendimento relativamente baixo, a cinética da ligação ligante-receptor tem sido tradicionalmente estudada em um momento tardio na descoberta de medicamentos. No entanto, a descoberta de medicamentos seria extremamente beneficiada por sua otimização, já que as taxas deKon e Koff afetam a eficiência, a ocorrência de efeitos colaterais, a eficácia e a duração da ação. Além disso, a cinética de ligação parece desempenhar uma função no agonismo tendencioso. Portanto, é desejável examinar a cinética de ligação dos candidatos a medicamentos em um momento inicial, antes de passar para modelos in vivo e estudos clínicos.
Os estudos de cinética de ligação (fig. 9) podem ser realizados com eficiência em leitores de placas que permitem a detecção cinética TR-FRET para fins de triagem e o estudo cinético de compostos de baixa afinidade, conforme discutido na palestra científica "A TR-FRET approach to measure the kinetics of ligand-receptor binding and its application of fragment screening" e na nota de aplicação "Analyze binding kinetics with HTRF".

Seus recursos exclusivos, dedicados a estudos de ligação cinética, tornam o PHERAstarFSX superior a qualquer outro leitor de microplacas atualmente no mercado. O leitor pode resolver facilmente eventos de ligação e calcular as taxas Kon e Koff graças à sua alta resolução temporal na detecção TR-FRET e às soluções dedicadas de hardware/software.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows