
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Detecte sinais bioluminescentes de flash e brilho com alta sensibilidade, desde estudos de genes repórteres até a quantificação de ATP.
A palavra luminescência é composta de "lumin" (latim para luz) e o sufixo "-escence" (usado para processos ou mudanças). Trata-se, portanto, de um processo no qual a luz é liberada. Por definição, a luminescência é proveniente de fontes frias e é diferenciada da emissão de fontes aquecidas (incandescência), como ferro quente ou uma vela acesa1. Os sinais luminosos podem ser gerados durante a conversão de energia de uma ampla gama de fontes de energia. O processo transforma energia invisível em radiação visível e pode ser usado na natureza como um mecanismo de defesa, para LEDs em telas ou para fins de análise. O conteúdo desta página se concentra no uso de métodos de luminescência em ciências biológicas, explica seu contexto físico, fornece informações sobre sua detecção em leitores de microplacas de luminescência e apresenta ensaios comuns de microplacas de luminescência. A eletroluminescência, a radioluminescência e a termoluminescência não fazem parte deste conteúdo, pois não são relevantes para este tópico.
A luminescência é a produção de um sinal luminoso por meio da conversão de energia. Sua aplicação nas ciências da vida se baseia principalmente em duas fontes de energia: energia química ou luminosa, levando à quimioluminescência e à fotoluminescência, respectivamente. Esta última também é a base da fluorescência (fosforescência).
A energia de uma das duas fontes é absorvida por uma molécula e leva seus elétrons a um nível de energia mais alto (Fig. 1). Como esse nível é instável, os elétrons voltam do estado excitado para o estado fundamental. Ao cair, os elétrons liberam energia na forma de energia vibracional, calor e fótons. Esta última é a emissão luminescente2.
Nas ciências da vida, "fluorescência" é comumente usada quando se fala de fosforescência ou fotoluminescência, enquanto "luminescência" normalmente se refere à quimioluminescência. Essa simplificação é apoiada pela diferença na detecção: a fluorescência requer uma fonte de excitação, enquanto a luminescência não (Fig. 2). Este conteúdo adere a essa nomenclatura comum e se concentra na quimioluminescência, também chamada de "luminescência".
Nessa reação, um substrato reage em um estado eletronicamente excitado. Os elétrons do produto ou intermediário excitado caem em seu estado de energia mais baixo, emitindo fótons e, portanto, sendo luminescentes. Um exemplo típico é a reação do luminol na presença de peróxido de hidrogênio (Fig. 3). Em um ambiente alcalino, esse substrato existe em uma forma (Dianion) que reage com o oxigênio molecular O2. O intermediário oxidado reage então a um ácido 3-aminoftálico (3-APA) eletronicamente excitado. A molécula então volta ao estado de energia que normalmente ocupa e libera luz. Esse princípio simples também é a base da quimio e bioluminescência aprimoradas. Portanto, ambas também são reações quimioluminescentes.
A ECL usa intensificadores em sua reação quimioluminescente. A ECL emprega principalmente luminol em conjunto com peróxido de hidrogênio. Entretanto, a oxidação é catalisada por uma enzima: a peroxidase de rábano (HRP). Além disso, as reações de ECL contêm produtos químicos que aumentam a produção de luz, como o ácido p-cumárico ou o ácido 4-iodofenilborônico. O uso de uma enzima para catalisar a reação química permite que o ECL seja usado em reações ligadas a enzimas. Sua principal aplicação é em immunoblots: as proteínas são separadas por tamanho, transferidas para uma membrana e detectadas por ECL. As proteínas de interesse imobilizadas na membrana são ligadas por um anticorpo específico de proteína. Um segundo anticorpo acoplado à peroxidase de rábano é usado para ligar a proteína-anticorpo à enzima. Graças às enzimas e aos intensificadores, um sinal brilhante é gerado somente onde a proteína é encontrada.
O mesmo princípio é empregado para a quantificação de biomoléculas com base em microplacas. Os ensaios ELISA com leitura luminescente têm maior sensibilidade e são baseados em ECL. A proteína de interesse é imobilizada no poço da microplaca e os anticorpos específicos, o anticorpo secundário acoplado a HRP, o substrato e o intensificador geram um sinal luminoso que aumenta com a concentração da proteína.
A bioluminescência ocorre em organismos vivos. O termo também abrange reações que usam enzimas e substratos originalmente derivados de organismos vivos, embora estejam sendo usados fora do organismo, ou que tenham sido objeto de bioengenharia para proporcionar características aprimoradas. A bioluminescência é usada para diferentes fins biológicos. Os vagalumes usam sua capacidade de brilhar para atrair parceiros. Acredita-se que as medusas, como a Aequorea victoria, ou os camarões de águas profundas usem a produção de luz para afastar inimigos biológicos. Durante a detecção de quorum, as bactérias , como a Vibrio fischeri marinha, geram um sinal luminoso quando atingem uma determinada densidade. Isso permite que a população se comunique e se coordene.
Como esses organismos conseguem gerar a luminescência? Por meio de uma enzima (luciferase) que catalisa a oxidação de substratos (luciferinas) e, assim, libera fótons. Organismos diferentes utilizam enzimas e substratos diferentes. Além disso, as reações de emissão de luz exigem diferentes cofatores e resultam em comprimentos de onda variados. A Figura 4 mostra três reações de luciferases amplamente usadas em ensaios de ciências biológicas.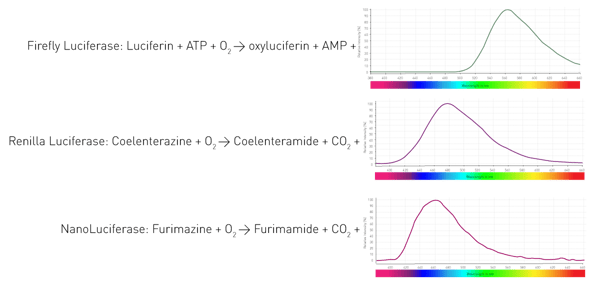
A transferência de energia de ressonância descreve a transferência de energia de uma molécula doadora eletronicamente excitada para um fluoróforo aceitador. O processo excita o fluoróforo aceitador que, por sua vez, emite fótons. Caso a energia do doador seja gerada por bioluminescência, o processo é chamado de transferência de energia de ressonância de bioluminescência (BRET). Várias condições devem ser atendidas para permitir a transferência: o espectro de emissão da molécula doadora precisa se sobrepor ao espectro de excitação do fluoróforo aceitador. Além disso, o doador e o aceitador precisam estar próximos (normalmente de 1 a 10 nm), pois a transferência diminui com a distância. Consequentemente, a BRET é comumente usada para medir a interação de duas biomoléculas. O resultado da BRET é a intensidade do fluoróforo do aceitador em relação à intensidade do doador, conhecida como razão BRET. BRET1, BRET2 e NanoBRET usam diferentes combinações de enzimas e fluoróforos aceitadores, conforme mostrado na tabela 1.
Tabela 1 - Tipos de BRET
| Nome da luciferase | Luciferase doadora | Substrato | Emissão do doador | Fluoróforo do receptor | Emissão do aceitador |
| BRET 1 |
Renilina |
Coelenterazina |
450-500 nm |
YFP | 515-560 nm |
| GFP |
510-540 nm | ||||
| BRET 2 | Renilla | DeepBlueC | 400-450 nm | GFP | 500-540 nm |
| NanoBRET | NanoLuc | Furimazina | 420-500 nm | NanoBRET 618 | 550-675 nm |
| TMR | 550-600 nm | ||||
| AlexaFluor 633 | 600-700 nm | ||||
| Vênus | 515-575 nm |
Os ensaios baseados em luminescência para aplicações em ciências biológicas usam reações de flash ou de brilho. A diferença entre os dois é a duração do sinal. Os ensaios de flash produzem um sinal por no máximo alguns segundos. A intensidade do flash de luz produzido é normalmente registrada diretamente do início ao fim da reação. Isso significa que as reações flash precisam ser iniciadas com a adição de um iniciador de reação. Nos leitores de microplacas, são necessáriosinjetores de reagentes para iniciar automaticamente a reação e registrar o sinal simultaneamente. Os ensaios populares de luminescência flash são a tecnologiaDual-Luciferase Reporter™ ouos ensaios SPARCL.
Em contraste com o flash, a luminescência incandescente gera sinais estáveis por até horas. Os ensaios não requerem dispensação automática e podem ser lidos em um período de tempo mais longo. Os pesquisadores, assim como os fornecedores de kits, tendem a preferir os ensaios de luminescência incandescente, pois são mais fáceis de manusear e detectar. Um dos representantes mais proeminentes da luminescência incandescente é o teste de viabilidade CellTiterGlo®.
Além da detecção por ECL em western blots, os testes de luminescência normalmente empregam microplacas (formatos de 6 a 1536 poços) e são quantificados usando um leitor de microplacas. Esta seção explica como a luminescência é medida em microplacas.
A luminescência é mais fácil de detectar do que a fluorescência ou a absorbância, pois não é necessária excitação. Isso significa que não é necessária uma fonte de luz nem uma seleção de comprimento de onda de excitação. Os componentes mínimos necessários são uma lente para coletar o sinal luminoso e um detector (Fig. 5). Uma ferramenta de seleção de comprimento de onda é necessária para medir a BRET e guias de luz podem ser necessários para construções de detecção específicas.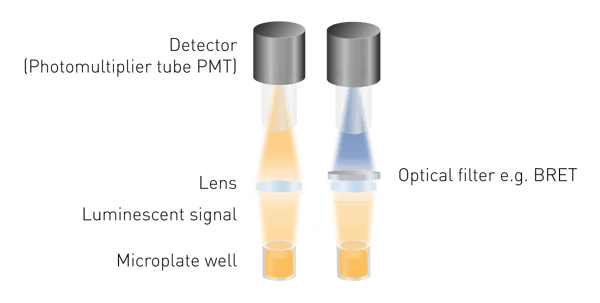
Os tubos fotomultiplicadores (PMTs) servem como detectores na detecção de luminescência. Os PMTs diferem em sua sensibilidade (o menor sinal detectável), seu ruído e sua capacidade de medir outros modos de detecção. Muitos dispositivos de medição vêm com um PMT universal que lê a luminescência e outros modos de detecção. Suas vantagens são os baixos requisitos de espaço e custo, apesar de oferecerem alta sensibilidade. A possibilidade de medir sinais muito baixos é fornecida por sistemas ópticos otimizados. Esse sistema otimizado é o caminho óptico de ar livre combinado com um módulo óptico de luminescência mais encontrado nos leitores de microplacas PHERAstar FSX.
Os PMTs dedicados para detecção de luminescência proporcionam um ruído mais baixo ou o uso de um princípio de contagem de fótons. Embora ambos os PMTs dedicados também possam detectar sinais baixos, um sistema de contagem de fótons é limitado na detecção de sinais mais altos (Fig. 6).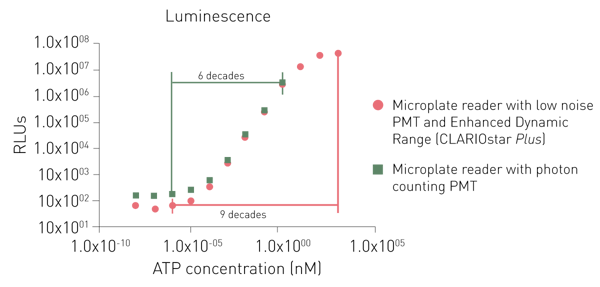
O ideal é que o detector seja colocado diretamente acima do poço. Se isso não for possível, o sinal luminoso precisa ser guiado do poço para o detector. Essa tarefa pode ser realizada por lentes e espelhos ou por um guia de luz. O guia absorve parte da luminescência, o que diminui a sensibilidade em comparação com um caminho óptico ao ar livre. Esse último pode ser encontrado nasleitoras de microplacas VANTAstar, CLARIOstar Plus e PHERAstar FSX.
Algumas aplicações exigem a detecção somente em um comprimento de onda específico para obter resultados ideais. Isso é feito por meio de filtros ópticos ou monocromadores colocados no caminho óptico. As medições BRET precisam de seleção de comprimento de onda, pois dois sinais vêm de uma mesma amostra. Para distinguir entre a luz proveniente do doador e do fluoróforo aceitador, são necessários dois filtros.
Os monocromadores convencionais baseados em grades desempenham um papel secundário na luminescência filtrada e na medição de BRET devido à sensibilidade limitada. Isso se deve aos efeitos de dispersão e às larguras de banda estreitas. No entanto, uma tecnologia de monocromador que usa filtros lineares variáveis (LVF) oferece a sensibilidade necessária. Um monocromador baseado em LVF apresenta transmissão semelhante a um filtro e fornece larguras de banda de até 100 nm. Isso garante que sinal suficiente chegue ao detector para luminescência filtrada, como a BRET (Fig. 7).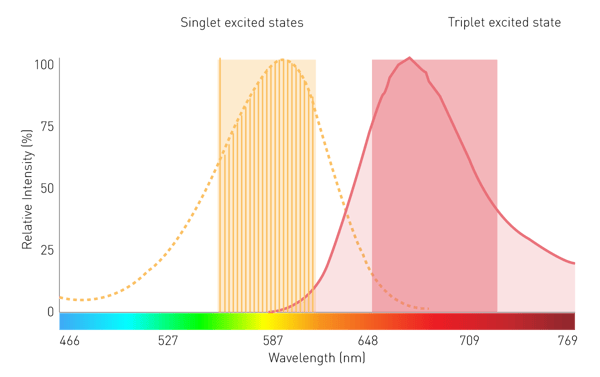
Um sinal luminescente dura um segundo ou mais e, portanto, é claramente diferente da fluorescência que decai em nanossegundos. Dessa forma, o sinal é normalmente detectado em um período de tempo entre 0,1 e 1 segundo. Esse tempo tem diferentes nomes: tempo de medição, tempo de integração e tempo de intervalo de medição. Ele depende de vários aspectos que precisam ser equilibrados entre si, como a intensidade do sinal e o tempo total de leitura de uma placa.
A detecção de luminescência em leitores de microplacas é relativamente fácil, pois normalmente requer menos configurações. Entretanto, há variáveis gerais e relacionadas ao instrumento que afetam as medições e a qualidade dos dados.
Conforme mencionado acima, o tempo de aquisição depende de vários fatores. Os seguintes aspectos devem ser considerados ao escolher o tempo de integração:
A maioria dos ensaios emite luz suficiente para que um sinal possa ser detectado em meio segundo a 0,02 segundo. Apenas muito raramente é necessário aumentar o tempo de integração para alguns segundos a fim de detectar diferenças nos sinais de luminescência.
Os sinais de brilho são normalmente adquiridos por 0,1 a 1 segundo, pois emitem um sinal estável. Portanto, o tempo total de leitura da placa, bem como o tempo e a duração da medição do sinal, desempenham papéis menores. Isso é diferente nos ensaios flash. Aqui, é importante coletar o sinal de emissão completo do início ao fim, o que pode levar vários segundos, dependendo do ensaio.
Se for importante saber qual é a aparência da curva de sinal e qual é a emissão máxima de uma reação flash, serão necessárias várias medições em tempos de integração muito baixos. Por exemplo, se uma reação leva aproximadamente um segundo, 50 medições de 0,02 s podem ser realizadas para cobrir um segundo e monitorar como o sinal se desenvolve e decai.
Esse ponto é relevante apenas para medições cinéticas. Caso uma reação baseada em células ou bioquímica seja monitorada com um ensaio luminescente, o curso de tempo da reação determina o tempo de integração. Por exemplo, no sensaios de cálcio do , as respostas ocorrem em um intervalo de 20 segundos após a estimulação e podem ser exibidas por 10 medições a cada 2 segundos. Se apenas um poço for medido, um tempo de integração de 1 ou 2 s pode ser escolhido e resulta em uma resolução temporal adequada. Entretanto, se mais poços precisarem ser lidos com a mesma resolução temporal (ponto de medição para cada poço a cada 2 segundos), o tempo de integração precisará ser reduzido para medir os poços restantes e evitar a perda de dados.
Como o tempo de integração é aplicado a cada poço, ele contribui amplamente para o tempo total de leitura de uma placa. Aumentar o tempo de integração em cada poço em apenas 0,2 s aumenta o tempo total de leitura de uma placa completa de 96 poços em 20 s e de uma placa de 384 poços em mais de um minuto. Portanto, é importante usar tempos de integração baixos em placas de alta densidade (placas de 384 ou 1536 poços) e em aplicações de alto rendimento em que milhares de placas precisam ser medidas em um dia.
O ganho pode ser considerado como um fator de amplificação que move uma janela de faixa dinâmica fixa ao longo da curva de concentração da amostra. Intensidades de sinal baixas exigem ganhos mais altos, enquanto sinais intensos exigem ganhos mais baixos. Normalmente, o ganho é definido para ter uma saída de medição máxima na amostra com a maior intensidade esperada. Isso é feito para ter a maior janela dinâmica possível entre os valores de medição mais altos e mais baixos. Portanto, se forem usados controles positivos com um sinal máximo junto com amostras desconhecidas, o ganho poderá ser ajustado neles.
A possibilidade de medir com diferentes ganhos, resultando em uma ampla faixa dinâmica, permite medir sinais muito baixos e emissões brilhantes com apenas um instrumento.
As configurações de ganho não são necessárias para todos os leitores de microplacas luminescentes, dependendo do detector e da automação do processo de ajuste de ganho.
Os modernos leitores de placas de luminescência realizam automaticamenteos ajustes de ganho. Isso não apenas elimina essa responsabilidade do pesquisador, mas também garante à medição uma ampla faixa dinâmica. Esses instrumentos são o CLARIOstar® Pluse o VANTAstar® com sua tecnologia Enhanced Dynamic Range.
As placas brancas são mais adequadas para a detecção de luminescência, pois refletem o sinal em vez de absorvê-lo. Você pode encontrar mais detalhes sobre a escolha da placa em nossa publicação no blog:"A microplaca: utilidade na prática".
É importante ressaltar que, se um ensaio luminescente e um fluorescente forem combinados no mesmo poço, é preferível usar uma placa preta. A fluorescência medida em uma placa branca leva a valores muito instáveis e a um sinal de fundo muito alto devido à reflexão da luz de excitação. Isso torna a detecção de fluorescência em placas brancas bastante problemática. A medição da luminescência em placas pretas reduz a janela do ensaio. No entanto, como o fundo é altamente reduzido e as medições apresentam desvios menores, as medições ainda devem fornecer resultados satisfatórios.
O cross-talk é a luz de qualquer outro poço, exceto o medido, que é medido de forma não específica pelo detector e modifica o sinal do poço medido de fato. É um fenômeno que afeta apenas a detecção de luminescência.
Como a luz produzida em uma reação luminescente é difusa, ela pode não apenas brilhar diretamente acima do poço, mas também se desviar para os poços vizinhos e diretamente para o local de detecção, mesmo que outro poço seja medido. Isso resulta em sinais tendenciosos, maior variação e menor sensibilidade geral. O problema pode ser resolvido por diferentes meios, dependendo do tipo de reação e da difusão do sinal.
Para ensaios de flash que brilham por apenas alguns segundos, basta medir a placa em uma ordem diferente. Como o sinal decai rapidamente, os únicos poços afetados pelo cross-talk são os adjacentes quando medidos diretamente um após o outro. Se for medido um poço distante em vez de um adjacente, o cross-talk será drasticamente reduzido, pois o sinal em declínio não é detectável no local distante. Para essa finalidade, os leitores de microplacas BMG LABTECH oferecem um modo de leitura entrelaçada. Esse modo mede um poço a cada dois até chegar ao final da placa. Em seguida, as zonas omitidas são medidas. Isso permite que os sinais medidos primeiro diminuam até que seus vizinhos diretos sejam medidos.
Os testes de brilho emitem sinais estáveis por horas e requerem outras estratégias para eliminar o cross-talk. Os sinais indesejados podem chegar ao local de detecção de duas maneiras: acima da placa e através da parede dos poços (Fig. 8). Ambas as maneiras precisam ser abordadas de forma diferente.
As aberturas bloqueiam fisicamente a luz indesejada que incide sobre os poços e chega ao detector. Uma abertura é um acessório preto em forma de colher com um orifício que é colocado acima da microplaca (Fig. 8). Através do orifício, o sinal do poço de interesse chega ao detector, enquanto toda a luz proveniente de seu entorno é fisicamente bloqueada. Os leitores de microplacas multimodo PHERAstar®FSX da BMG LABTECH,bem como o VANTAstar® e o CLARIOstar® Plus, vêmcom aberturas para melhorar a detecção de luminescência.
 b) Redução matemática do cross-talk
b) Redução matemática do cross-talkA luz pode atravessar a parede plástica de um poço, mesmo em microplacas brancas. O tipo de microplaca afeta significativamente a interferência que brilha através das paredes de uma placa. Em geral, as placas de maior densidade (por exemplo, 1536 poços) apresentam maior vazamento de luz através das paredes do que as placas de menor densidade, pois as paredes são mais finas. Um segundo aspecto é a geometria do poço: os poços quadrados têm uma maior passagem através da parede porque os poços adjacentes compartilham uma parede. Os poços redondos não compartilham a parede e, portanto, apresentam menor diafonia através da parede. Além disso, a cor da placa influencia a comunicação cruzada através das paredes da microplaca: quanto mais escura a placa, menor a comunicação cruzada. As placas cinzas oferecem um compromisso entre a redução da interferência e a reflexão do sinal.
Se não for possível otimizar ainda mais a placa, uma redução matemática do cross-talk pode ser aplicada aos dados adquiridos. Para isso, é determinado o sangramento do sinal para os poços vizinhos e um algoritmo corrige os dados. Uma determinação automática e uma correção de cross-talk são encontradas nos leitores de placas BMG LABTECH PHERAstar®FSX, VANTAstar® eCLARIOstar®Plus.
As placas brancas têm uma fosforescência intrínseca: a luz é emitida pela própria placa após a exposição à luz. Esse sinal pode alterar os dados, aumentando os espaços em branco e reduzindo a janela do ensaio. Por isso, recomenda-se preparar a placa no escuro ou deixá-la no escuro aproximadamente 15 minutos antes da medição.
Os filtros são necessários principalmente para medições BRET. Como a luminescência geralmente apresenta saídas de sinal baixas, recomenda-se usar filtros com uma largura de banda ampla de 80 a 100 nm. As larguras de banda mais amplas resultam em mais luz chegando ao detector e aumentam a sensibilidade da medição.
Os ensaios com repórteres usam sequências reguladoras de genes combinadas com as informações genéticas de uma molécula repórter para estudar a alteração na expressão gênica ou as modificações na própria região reguladora. A informação genética do gene repórter precisa ser introduzida nas células. Se o gene repórter estiver ativo, a enzima será transcrita e traduzida. Na presença de um substrato, ela é convertida, a luz é produzida e sua emissão informa sobre a atividade das sequências reguladoras.
Osensaios de repórter de luciferase dupla (DLR™) acrescentam um segundo repórter ao sistema. Ao lado da luciferase acoplada a uma sequência reguladora de interesse, uma segunda luciferase controlada por um promotor "housekeeping" serve como controle interno. Usando o CLARIOstar ou o VANTAstar e sua opção de varredura de luminescência, é possível identificar luciferases correspondentes e combinar, por exemplo, até seis luciferases em um único ensaio de multiplexação de luciferase.
O ensaio de viabilidade mais popular é baseado na enzima do vagalume. Sua atividade aumenta com o aumento dos níveis de ATP, assim como a emissão de luz. As células viáveis produzem ATP, que, após a lise celular, alimenta a reação. Dessa forma, a emissão se correlaciona com o número e a viabilidade das células. Além dos ensaios de viabilidade de ponto final baseados em ATP, os ensaios luminescentes podem medir a viabilidade celular em tempo real. Para isso, um pró-substrato e a enzima do vaga-lume são adicionados à cultura de células. O pró-substrato é reduzido apenas por células viáveis e, em seguida, é processado em uma reação de emissão de luz. Dessa forma, a luminescência informa sobre as alterações de viabilidade em tempo real. Você pode saber mais sobre esses ensaios em nossa palestra científica "Real-time cell health assays deliver better data with less effort". Os ensaios de viabilidade celular também são relevantes para o trabalho com PROteolysis TArgeting Chimeras (PROTACs) e colas moleculares na degradação de proteínas direcionadas para a descoberta de medicamentos. Isso inclui pesquisas que envolvem a degradação direcionada de proteínas resultante de interações específicas entre degrons e ligases conhecidos.

O metabolismo celular abrange diferentes etapas de conversão molecular. Muitos dos ensaios disponíveis para detectar as vias celulares metabólicas são baseados em luminescência. O metabolismo básico concentra-se no uso dos principais nutrientes, como a glicose. O consumo de glicose pode ser monitorado, por exemplo, pelo ensaio de globo de glicose. Para a medição indireta do consumo de glicose, o produto de decomposição da glicose - o lactato - também pode ser detectado com o ensaio glo de lactato. O desempenho de ambos os ensaios é demonstrado na nota de aplicação: O ensaio de glicose e o ensaio de lactato permitem monitorar o metabolismo celular da glicose com precisão em um ensaio baseado em células. Na nota de aplicação: Detecção de ROS em um formato baseado em células usando o ensaio Promega ROS-Glo™, é mostrado o uso de um ensaio baseado em luminescência para a detecção de espécies reativas de oxigênio excessivamente produzidas.
Os receptores são alvos comuns de medicamentos e seus ligantes são possíveis terapêuticos. A ligação de ligantes a seus receptores pode ser estudada em ensaios baseados em células usando o princípio BRET. A luciferase é expressa na parte extracelular do receptor e um ligante é marcado com um fluoróforo aceitador adequado. Se o ligante se ligar ao seu receptor, o doador e o aceitador estarão próximos o suficiente para transferir energia e a taxa BRET aumentará. O método permite ainda estudar a ligação do receptor de compostos não marcados. Eles podem competir pela ligação com um ligante conhecido, marcado com um fluoróforo. Se a taxa BRET diminuir em uma configuração competitiva, um composto não marcado deslocou a molécula aceitadora, levando a uma perda de transferência (Fig. 9).
Como esses ensaios ajudam a estudar a farmacologia do receptor é explicado em nossa palestra científica "Real-time profiling of receptor pharmacology"(Perfil em tempo real da farmacologia do receptor).

O princípio do BRET também é usado para estudar a interação de duas proteínas. Para isso, uma das proteínas em interação é acoplada à luciferase e a outra a um fluoróforo aceitador. Após a interação de ambas, ocorre a transferência de energia que leva à emissão do fluoróforo e a um aumento na taxa BRET. Isso pode, por exemplo, ser usado para estudar a dissociação da proteína G e o recrutamento da β-arrestina. Um método alternativo para estudar a interação usando luminescência é o HiBiT CETSA descrito na nota de aplicação: Measuring protein ligand binding with an endogenous HiBiT CETSA test system. Essa abordagem utiliza uma nanoluciferase HiBiT fragmentada fundida a uma proteína-alvo de interesse (POI) e pode ser usada para rastrear PROteolysis TArgeting Chimeras (PROTACs) e colas moleculares na degradação de proteínas específicas. Esse tipo de abordagem também é relevante para o estudo da degradação de proteínas direcionadas decorrente de interações específicas entre degrões e ligases conhecidos. Embora em condições fisiológicas a luciferase fragmentada possa ser completada para formar uma enzima funcional com leitura luminescente, a aplicação de calor impede esse efeito devido à desnaturação do POI. A ligação de um ligante aumentará a estabilidade térmica do POI, levando a uma mudança mensurável de seu ponto de fusão.
Além da interação proteína-proteína, o princípio BRET também pode ser empregado para a detecção de biomoléculas, funcionando como um biossensor. Nesse exemplo, foi estudada a ativação diferencial de proteínas G por agonistas sintéticos de receptores canabinoides, utilizando o biossensor CAMYEL BRET.
Os ensaios de luminescência em microplacas geralmente são mais sensíveis do que seus equivalentes baseados em outros mecanismos. Por exemplo, os ELISAs luminescentes e os ensaios de viabilidade são mais sensíveis do que os ensaios colorimétricos e baseados em absorbância, respectivamente. Além disso, eles oferecem soluções para uma ampla variedade de questões biológicas. Devido à sua natureza sensível, eles são altamente utilizados em baixos volumes em aplicações de alto rendimento. Para sua detecção, é necessária uma instrumentação tão sensível quanto o próprio método. Uma vantagem para o uso da luminescência fora do HTS é a disponibilidade de ensaios homogêneos baseados em um princípio de adição e medição que torna os ensaios fáceis e rápidos de processar. Além disso, uma variedade de ensaios luminescentes em tempo real permite a quantificação dos processos celulares à medida que eles ocorrem.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series