
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Rileva i segnali bioluminescenti flash e glow con elevata sensibilità, dagli studi sui geni reporter alla quantificazione dell'ATP.
La parola luminescenza è composta da "lumin" (latino per luce) e dal suffisso "-escenza" (usato per processi o cambiamenti). Si tratta quindi di un processo in cui viene rilasciata la luce. Per definizione, la luminescenza deriva da sorgenti fredde e si distingue dall'emissione da sorgenti riscaldate (incandescenza), come il ferro caldo o una candela accesa1. I segnali luminosi possono essere generati durante la conversione di energia da un'ampia gamma di fonti energetiche. Il processo trasforma l'energia invisibile in radiazione visibile e può essere utilizzato in natura come meccanismo di difesa, per i LED sugli schermi o per scopi di analisi. Il contenuto di questa pagina si concentra sull'uso dei metodi di luminescenza nelle scienze biologiche, ne illustra il contesto fisico, fornisce informazioni sulla sua rilevazione sui lettori di micropiastre a luminescenza e presenta i comuni saggi in micropiastra a luminescenza. L'elettroluminescenza, la radioluminescenza e la termoluminescenza non fanno parte di questo contenuto in quanto non pertinenti a questo argomento.
La luminescenza è la produzione di un segnale luminoso attraverso la conversione di energia. La sua applicazione nelle scienze della vita si basa principalmente su due fonti di energia: l'energia chimica o quella luminosa, che portano rispettivamente alla chemi- e alla fotoluminescenza. Quest'ultima è anche alla base della fluorescenza (fosforescenza).
L'energia di una delle due fonti viene assorbita da una molecola e porta i suoi elettroni a un livello energetico superiore (Fig. 1). Poiché questo livello è instabile, gli elettroni ricadono dallo stato eccitato a quello terreno. Nel ricadere, gli elettroni rilasciano energia sotto forma di energia vibrazionale, calore e fotoni. Quest'ultima è l'emissione luminescente2.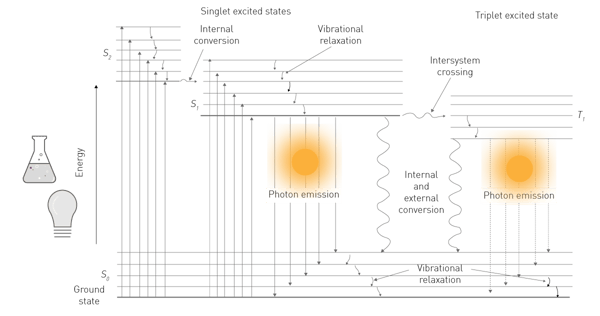
Nelle scienze biologiche, il termine "fluorescenza" è comunemente usato quando si parla di fosforescenza o fotoluminescenza, mentre "luminescenza" si riferisce tipicamente alla chemiluminescenza. Questa semplificazione è supportata dalla differenza di rilevazione: la fluorescenza richiede una fonte di eccitazione, mentre la luminescenza no (Fig. 2). Questo contenuto si attiene a questa nomenclatura comune e si concentra sulla chemiluminescenza, di seguito indicata come "luminescenza".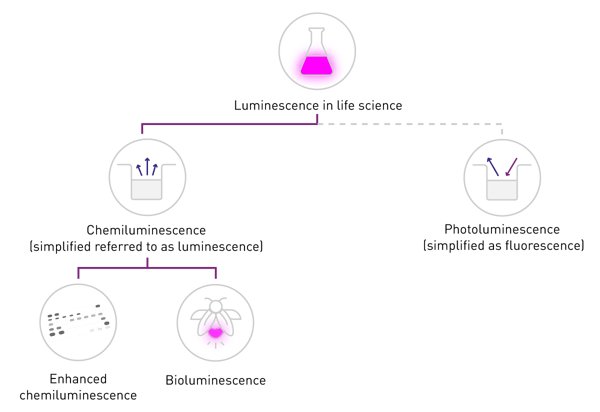
In questa reazione, un substrato reagisce in uno stato elettronicamente eccitato. Gli elettroni del prodotto o dell'intermedio eccitato cadono nel loro stato di energia più basso emettendo fotoni e risultando quindi luminescenti. Un esempio tipico è la reazione del luminol in presenza di perossido di idrogeno (Fig. 3). In un ambiente alcalino, questo substrato esiste in una forma (Dianion) che reagisce con l'ossigeno molecolare O2. L'intermedio ossidato reagisce quindi a un acido 3-aminoftalico (3-APA) elettronicamente eccitato. La molecola torna quindi allo stato energetico che occupa normalmente e rilascia la luce. Questo semplice principio è anche alla base della chemioluminescenza e della bioluminescenza potenziata. Entrambe sono quindi reazioni chemiluminescenti.
L'ECL utilizza potenziatori nella sua reazione chemiluminescente. L'ECL utilizza principalmente il luminolo in combinazione con il perossido di idrogeno. Tuttavia, l'ossidazione è catalizzata da un enzima: la perossidasi di rafano (HRP). Inoltre, le reazioni ECL contengono sostanze chimiche che potenziano la produzione di luce, come l'acido p-cumarico o l'acido 4-iodofenilboronico. L'uso di un enzima per catalizzare la reazione chimica consente di utilizzare l'ECL nelle reazioni enzimatiche. La sua applicazione principale è negli immunoblot: le proteine vengono separate per dimensione, trasferite su una membrana e rilevate mediante ECL. Le proteine di interesse immobilizzate sulla membrana sono legate da un anticorpo specifico per la proteina. Un secondo anticorpo, accoppiato alla perossidasi di rafano, viene utilizzato per collegare la proteina-anticorpo all'enzima. Grazie agli enzimi e agli esaltatori, viene generato un segnale luminoso solo dove si trova la proteina.
Lo stesso principio viene utilizzato per la quantificazione delle biomolecole su micropiastra. I test ELISA con lettura luminescente hanno una maggiore sensibilità e si basano sull'ECL. La proteina di interesse viene immobilizzata sul pozzetto della micropiastra e gli anticorpi specifici, l'anticorpo secondario accoppiato con HRP, il substrato e l'esaltatore generano un segnale luminoso che aumenta con la concentrazione della proteina.
La bioluminescenza si verifica negli organismi viventi. Il termine comprende anche le reazioni che utilizzano enzimi e substrati originariamente derivati da organismi viventi, anche se utilizzati al di fuori dell'organismo, o bioingegnerizzati per fornire caratteristiche migliori. La bioluminescenza viene utilizzata per diversi scopi biologici. Le lucciole sfruttano la loro capacità di brillare per attirare i compagni. Si pensa che le meduse, come l'Aequorea victoria o i gamberi di profondità, utilizzino la produzione di luce per allontanare i nemici biologici. Durante il quorum sensing, batteri come il Vibrio fischeri marino generano un segnale luminoso quando raggiungono una certa densità. Questo permette alla popolazione di comunicare e coordinarsi.
Come fanno questi organismi a generare la luminescenza? Grazie a un enzima (luciferasi) che catalizza l'ossidazione dei substrati (luciferine) e quindi rilascia fotoni. Organismi diversi utilizzano enzimi e substrati diversi. Inoltre, le reazioni di emissione della luce richiedono diversi cofattori e danno luogo a lunghezze d'onda diverse. La Figura 4 mostra tre reazioni di luciferasi ampiamente utilizzate nei test di scienze biologiche.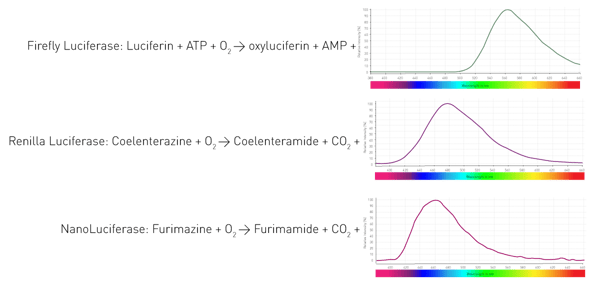
Il trasferimento di energia di risonanza descrive il trasferimento di energia da una molecola donatrice eccitata elettronicamente a un fluoroforo accettore. Il processo eccita il fluoroforo accettore che a sua volta emette fotoni. Nel caso in cui l'energia del donatore sia generata dalla bioluminescenza, il processo è chiamato trasferimento di energia di risonanza di bioluminescenza (BRET). Per consentire il trasferimento devono essere soddisfatte diverse condizioni: lo spettro di emissione della molecola donatrice deve sovrapporsi allo spettro di eccitazione del fluoroforo accettore. Inoltre, donatore e accettore devono essere vicini (in genere 1-10 nm), poiché il trasferimento diminuisce con la distanza. Di conseguenza, la BRET è comunemente utilizzata per misurare l'interazione di due biomolecole. Il risultato della BRET è l'intensità del fluoroforo accettore rispetto all'intensità del donatore, nota come rapporto BRET. BRET1, BRET2 e NanoBRET utilizzano diverse combinazioni di enzimi e fluorofori accettori, come illustrato nella tabella 1.
Tabella 1 - Tipi di BRET
| Nome | Donatore luciferasi | Substrato | Emissione del donatore | Fluoroforo dell'accettore | Emissione dell'accettore |
| BRET 1 |
Renilla |
Celenterazina |
450-500 nm |
YFP | 515-560 nm |
| GFP |
510-540 nm | ||||
| BRET 2 | Renilla | DeepBlueC | 400-450 nm | GFP | 500-540 nm |
| NanoBRET | NanoLuc | Furimazina | 420-500 nm | NanoBRET 618 | 550-675 nm |
| TMR | 550-600 nm | ||||
| AlexaFluor 633 | 600-700 nm | ||||
| Venere | 515-575 nm |
I saggi basati sulla luminescenza per le applicazioni delle scienze biologiche utilizzano reazioni flash o glow. La differenza tra i due è la durata del segnale. I saggi flash producono un segnale della durata massima di un paio di secondi. L'intensità del fascio di luce prodotto viene in genere registrata direttamente dall'inizio alla fine della reazione. Di conseguenza, le reazioni flash devono essere avviate con l'aggiunta di uno starter di reazione. Nei lettori di micropiastre, sono necessari iniettori di reagenti per avviare automaticamente la reazione e registrare contemporaneamente il segnale. I più diffusi saggi di luminescenza flash sono la tecnologia Dual-Luciferase Reporter™ o i saggi SPARCL.
A differenza della luminescenza flash, la luminescenza glow genera segnali stabili fino a ore. Questi saggi non richiedono la dispensazione automatica e possono essere letti per un periodo di tempo più lungo. I ricercatori, così come i fornitori di kit, tendono a preferire i saggi glow perché sono più facili da maneggiare e da rilevare. Uno dei più importanti rappresentanti della luminescenza a bagliore è il test di vitalità CellTiterGlo®.
Oltre alla rivelazione ECL nei western blot, i test di luminescenza utilizzano tipicamente micropiastre (formati da 6 a 1536 pozzetti) e vengono quantificati con un lettore di micropiastre. Questa sezione spiega come viene misurata la luminescenza nelle micropiastre.
La luminescenza è più facile da rilevare rispetto alla fluorescenza o all'assorbanza, poiché non è necessaria l'eccitazione. Ciò significa che non sono necessarie né una sorgente di luce né una selezione della lunghezza d'onda di eccitazione. I componenti minimi necessari sono una lente per raccogliere il segnale luminoso e un rilevatore (Fig. 5). Per misurare la BRET è necessario uno strumento di selezione delle lunghezze d'onda e le guide di luce possono essere necessarie per strutture di rilevamento specifiche.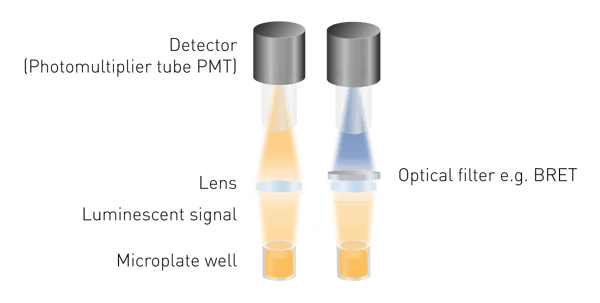
I tubi fotomoltiplicatori (PMT) servono come rivelatori nella rilevazione della luminescenza. I PMT si differenziano per la sensibilità (il minimo segnale rilevabile), il segnale aspecifico e la capacità di misurare altre modalità di rilevamento. Molti dispositivi di misura sono dotati di un PMT universale che legge la luminescenza e altre modalità di rilevamento. I loro vantaggi sono i bassi requisiti di spazio e di costo, nonostante l'elevata sensibilità. La possibilità di misurare segnali molto bassi è data da sistemi ottici ottimizzati. Un sistema ottimizzato è il percorso ottico in aria libera combinato con un modulo ottico a luminescenza plus presente nei lettori di micropiastre PHERAstar FSX.
I PMT dedicati per il rilevamento della luminescenza offrono un segnale aspecifico inferiore o l'utilizzo di un principio di conteggio dei fotoni. Mentre entrambi i PMT dedicati possono rilevare anche segnali bassi, un sistema di conteggio dei fotoni è limitato nella rilevazione di segnali più elevati (Fig. 6).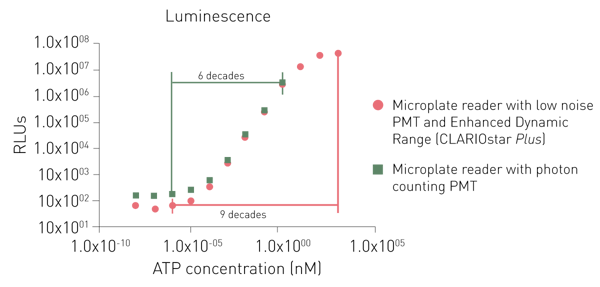
L'ideale sarebbe posizionare il rivelatore direttamente sopra il pozzetto. Se ciò non è possibile, il segnale luminoso deve essere guidato dal pozzetto al rivelatore. Questo compito può essere svolto da lenti e specchi o da una guida luminosa. La guida assorbe parte della luminescenza, riducendo la sensibilità rispetto a un percorso ottico in aria libera. Quest'ultima è presente nei lettori di micropiastre VANTAstar, CLARIOstar Plus e PHERAstar FSX.
Alcune applicazioni richiedono la rilevazione solo a una specifica lunghezza d'onda per ottenere risultati ottimali. A questo scopo si utilizzano filtri ottici o monocromatori posizionati nel percorso ottico. Le misurazioni BRET richiedono la selezione della lunghezza d'onda poiché due segnali provengono dallo stesso campione. Per distinguere tra la luce proveniente dal fluoroforo donatore e quella proveniente dal fluoroforo accettore sono necessari due filtri.
I monocromatori convenzionali basati su reticoli svolgono un ruolo secondario nelle misure di luminescenza filtrata e BRET a causa della sensibilità limitata. Ciò è dovuto agli effetti di scattering e alle strette larghezze di banda. Tuttavia, una tecnologia monocromatica che utilizza filtri lineari variabili (LVF) fornisce la sensibilità necessaria. Un monocromatore basato su LVF presenta una trasmissione simile a quella di un filtro e fornisce una larghezza di banda fino a 100 nm. Ciò garantisce che il segnale raggiunga il rivelatore in quantità sufficiente per la luminescenza filtrata come la BRET (Fig. 7).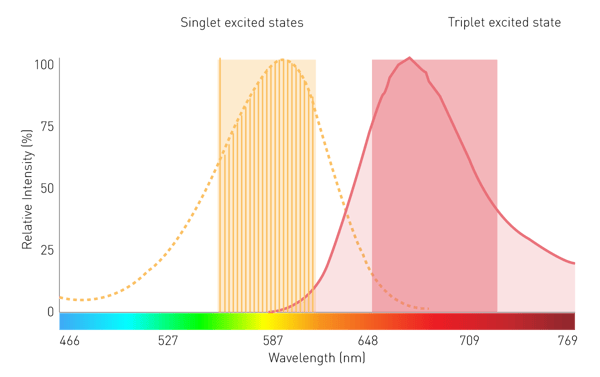
Un segnale luminescente dura un secondo o più ed è quindi chiaramente diverso dalla fluorescenza che decade in nanosecondi. Di conseguenza, il segnale viene tipicamente rilevato in un periodo di tempo compreso tra 0,1 e 1 secondo. Questo tempo ha nomi diversi: tempo di misurazione, tempo di integrazione e tempo di intervallo di misurazione. Dipende da diversi aspetti che devono essere bilanciati tra loro, come l'intensità del segnale e il tempo totale di lettura di una piastra.
La rilevazione della luminescenza nei lettori di micropiastre è relativamente semplice, poiché in genere richiede un numero ridotto di impostazioni. Tuttavia, esistono variabili generali e legate allo strumento che influiscono sulle misurazioni e sulla qualità dei dati.
Come già detto, il tempo di acquisizione dipende da diversi fattori. Nella scelta del tempo di integrazione si devono considerare i seguenti aspetti:
La maggior parte dei test emette una quantità di luce tale da consentire la rilevazione di un segnale in un tempo compreso tra mezzo secondo e 0,02 secondi. Solo molto raramente è necessario aumentare il tempo di integrazione fino a qualche secondo per rilevare differenze nei segnali di luminescenza.
I segnali di luminescenza sono generalmente acquisiti per 0,1 - 1 secondi, poiché emettono un segnale stabile. Pertanto, il tempo totale di lettura della piastra, così come la tempistica e la durata della misurazione del segnale, giocano un ruolo minore. La situazione è diversa nei saggi flash. In questo caso, è importante raccogliere il segnale di emissione completo dall'inizio alla fine, che può durare diversi secondi, a seconda del test.
Se è importante conoscere l'aspetto della curva del segnale e l'emissione massima di una reazione flash, è necessario eseguire più misurazioni a tempi di integrazione molto bassi. Ad esempio, se una reazione dura circa un secondo, è possibile eseguire 50 misurazioni di 0,02 s per coprire un secondo e monitorare l'andamento e il decadimento del segnale.
Questo punto è rilevante solo per le misure cinetiche. Nel caso in cui una reazione cellulare o biochimica venga monitorata con un saggio luminescente, il tempo di integrazione è dettato dall'andamento della reazione. Ad esempio, nei test sul calcio di le risposte avvengono in un intervallo di 20 secondi dopo la stimolazione e possono essere visualizzate con 10 misurazioni ogni 2 secondi. Se si misura un solo pozzetto, si può scegliere un tempo di integrazione di 1 o 2 s, con una risoluzione temporale adeguata. Tuttavia, se è necessario leggere più pozzetti con la stessa risoluzione temporale (punto di misurazione per ogni pozzetto ogni 2 secondi), il tempo di integrazione deve essere ridotto per misurare i pozzetti rimanenti ed evitare la perdita di dati.
Poiché il tempo di integrazione viene applicato a ciascun pozzetto, esso contribuisce in larga misura al tempo di lettura totale di una piastra. Aumentando il tempo di integrazione su ciascun pozzetto di soli 0,2 s, il tempo di lettura totale di una piastra a 96 pozzetti aumenta di 20 s e quello di una piastra a 384 pozzetti di oltre un minuto. Pertanto, è importante utilizzare tempi di integrazione bassi nelle piastre ad alta densità (piastre a 384 o 1536 pozzetti) e nelle applicazioni ad alta produttività in cui è necessario misurare migliaia di piastre in un giorno.
Il gain può essere considerato come un fattore di amplificazione che sposta una finestra di intervallo dinamico fisso lungo la curva di concentrazione del campione. Le basse intensità del segnale richiedono guadagni più elevati, mentre i segnali intensi richiedono guadagni più bassi. Di solito, il gain viene impostato in modo da avere un'uscita di misura massima sul campione con l'intensità più alta prevista. Questo per avere la più ampia finestra dinamica possibile tra i valori di misurazione più alti e quelli più bassi. Pertanto, se si utilizzano controlli positivi con un segnale massimo insieme a campioni sconosciuti, il gain può essere regolato su di essi.
La possibilità di misurare con gain diversi, con un'ampia gamma dinamica, consente di misurare segnali molto bassi ed emissioni luminose con un solo strumento.
La regolazione del gain non è necessaria per tutti i lettori di micropiastre luminescenti, a seconda del rivelatore e dell'automazione del processo di regolazione del guadagno.
I moderni lettori di micropiastre a luminescenza eseguono automaticamente la regolazione del guadagno. Ciò non solo toglie questa responsabilità al ricercatore, ma assicura anche alla misurazione un ampio intervallo dinamico. Tali strumenti sono il CLARIOstar® Plus e il VANTAstar® con lasua tecnologia Enhanced Dynamic Range.
Le piastre bianche sono le più adatte per la rilevazione della luminescenza, poiché riflettono il segnale invece di assorbirlo. Per maggiori dettagli sulla scelta delle piastre, consultare il nostro blog post:"La micropiastra: utilità nella pratica".
È importante notare che se un saggio luminescente e uno fluorescente sono combinati nello stesso pozzetto, è preferibile una piastra nera. La fluorescenza misurata in una piastra bianca porta a valori molto instabili e a un segnale di fondo molto elevato a causa della riflessione della luce di eccitazione. Ciò rende la rilevazione della fluorescenza in piastre bianche piuttosto problematica. La misurazione della luminescenza in piastre nere riduce la finestra del saggio. Tuttavia, poiché il background è molto ridotto e le misurazioni presentano deviazioni inferiori, le misure dovrebbero comunque fornire risultati soddisfacenti.
Il cross-talk è la luce proveniente da un pozzetto diverso da quello misurato che viene misurata in modo non specifico dal rivelatore e modifica il segnale del pozzetto effettivamente misurato. È un fenomeno che riguarda solo la rilevazione della luminescenza.
Poiché la luce prodotta in una reazione luminescente è diffusa, può non solo brillare direttamente sopra il pozzetto, ma anche diffondersi nei pozzetti vicini e direttamente nel sito di rilevamento, anche se viene misurato un altro pozzetto. Questo porta a segnali distorti, a una maggiore variazione e a una minore sensibilità complessiva. Il problema può essere risolto con diversi mezzi, a seconda del tipo di reazione e della diffusione del segnale.
Per i saggi flash che brillano solo per pochi secondi, è sufficiente misurare la piastra in un ordine diverso. Poiché il segnale decade rapidamente, gli unici pozzetti interessati dal cross-talk sono quelli adiacenti se misurati direttamente l'uno dopo l'altro. Se si misura un pozzetto distante anziché uno adiacente, il cross-talk diminuisce drasticamente poiché il segnale in decadimento non è rilevabile nel sito distante. A questo scopo, i lettori di micropiastre BMG LABTECH offrono una modalità di lettura interlacciata. Questa modalità misura ogni pozzetto fino a raggiungere la fine della piastra. Quindi vengono misurate le zone omesse. In questo modo, i segnali misurati per primi decadono fino a quando non vengono misurati i loro vicini diretti.
I test Glow emettono segnali stabili per ore e richiedono altre strategie per eliminare il cross-talk. I segnali indesiderati possono raggiungere il sito di rilevamento in due modi: sopra la piastra e attraverso la parete dei pozzetti (Fig. 8). Entrambe le vie devono essere affrontate in modo diverso.
Le aperture bloccano fisicamente la luce indesiderata che filtra dai pozzetti verso il rivelatore. Un'apertura è un accessorio nero a forma di cucchiaio con un foro che viene posizionato sopra la micropiastra (Fig. 8). Attraverso il foro, il segnale del pozzetto di interesse raggiunge il rilevatore, mentre tutta la luce proveniente dai suoi dintorni viene fisicamente bloccata. I lettori di micropiastre multimodali PHERAstar®FSX di BMG LABTECH, così come VANTAstar® e CLARIOstar® Plus, sonodotati di aperture per migliorare la rilevazione della luminescenza.
 b) Riduzione del cross-talk matematico
b) Riduzione del cross-talk matematicoLa luce può trasparire attraverso la parete di plastica di un pozzetto, anche nelle micropiastre bianche. Il tipo di micropiastra influisce in modo significativo sul cross-talk che attraversa le pareti della piastra. In genere, le piastre a densità più elevata (ad esempio, 1536 pozzetti) presentano una maggiore dispersione di luce attraverso le pareti rispetto alle piastre a densità inferiore, poiché le pareti sono più sottili. Un secondo aspetto è la geometria dei pozzetti: i pozzetti quadrati hanno un maggiore through-the-wall-cross-talk tra le pareti dei pozzetti perché i pozzetti adiacenti condividono una parete. I pozzetti rotondi non condividono la parete e, quindi, presentano un minore cross-talk attraverso la parete. Inoltre, il colore della piastra influenza il cross-talk attraverso le pareti della micropiastra: più scura è la piastra, minore è il cross-talk. Le piastre grigie offrono un compromesso tra la riduzione del cross-talk e la riflessione del segnale.
Se non è possibile ottimizzare ulteriormente la piastra, è possibile applicare una riduzione matematica del cross-talk ai dati acquisiti. A tal fine, viene determinato il bleed-through del segnale nei pozzetti vicini e un algoritmo corregge i dati. La determinazione automatica e la correzione del cross-talk sono presenti nei lettori di piastre BMG LABTECH PHERAstar®FSX, VANTAstar® e CLARIOstar®Plus.
Le piastre bianche hanno una fosforescenza intrinseca: la luce viene emessa dalla piastra stessa dopo l'esposizione alla luce. Questo segnale può alterare i dati, aumentando gli spazi vuoti e riducendo la finestra del saggio. Pertanto, si raccomanda di preparare la piastra al buio o di lasciarla al buio circa 15 minuti prima della misurazione.
I filtri sono necessari soprattutto per le misure BRET. Poiché la luminescenza presenta spesso bassi livelli di segnale, si consiglia di utilizzare filtri con un'ampia larghezza di banda di 80-100 nm. Una larghezza di banda più ampia fa sì che una maggiore quantità di luce raggiunga il rivelatore e aumenta la sensibilità della misura.
I saggi reporter utilizzano sequenze di regolazione genica combinate con le informazioni genetiche di una molecola reporter per studiare il cambiamento dell'espressione genica o le modifiche della regione di regolazione stessa. L'informazione genetica del gene reporter deve essere introdotta nelle cellule. Se il gene reporter è attivo, l'enzima viene trascritto e tradotto. In presenza di un substrato, viene convertito, viene prodotta luce e la sua emissione segnala l'attività delle sequenze regolatorie.
Isaggi reporter a doppia luciferasi (DLR™) aggiungono un secondo reporter al sistema. Accanto a quello accoppiato alla sequenza regolatoria di interesse, una seconda luciferasi controllata da un promotore "housekeeping" funge da controllo interno. Utilizzando CLARIOstar o VANTAstar e la loro opzione di scansione della luminescenza, è possibile identificare luciferasi corrispondenti e combinare, ad esempio, fino a sei luciferasi in un singolo saggio luciferasico multiplexing.
Il saggio di vitalità più diffuso si basa sull'enzima della lucciola. La sua attività aumenta con l'aumentare dei livelli di ATP e così l'emissione di luce. Le cellule vitali producono ATP, che dopo la lisi cellulare alimenta la reazione. Di conseguenza, l'emissione è correlata al numero di cellule e alla vitalità. Oltre ai saggi di vitalità endpoint basati sull'ATP, i saggi luminescenti possono misurare la vitalità cellulare in tempo reale. A questo scopo, alla coltura cellulare vengono aggiunti un pro-substrato e l'enzima della lucciola. Il pro-substrato viene ridotto solo dalle cellule vitali e viene quindi elaborato in una reazione che emette luce. In questo modo, la luminescenza segnala le variazioni di vitalità in tempo reale. Per saperne di più su questi saggi, consultate il nostro intervento scientifico "Real-time cell health assays deliver better data with less effort". I saggi di vitalità cellulare sono importanti anche per il lavoro con le PROteolysis TArgeting Chimeras (PROTACs) e le colle molecolari nella degradazione mirata delle proteine per lo sviluppo di farmaci. Ciò include la ricerca sulla degradazione mirata delle proteine derivante da interazioni specifiche tra degroni e ligasi noti.

Il metabolismo cellulare comprende diverse fasi di conversione molecolare. Molti dei test disponibili per rilevare le vie metaboliche cellulari sono basati sulla luminescenza. Il metabolismo di base si concentra sull'utilizzo dei principali nutrienti, come il glucosio. Il consumo di glucosio può essere monitorato, ad esempio, con il glucose glo assay. Per misurare indirettamente il consumo di glucosio, è possibile rilevare anche il prodotto di degradazione del glucosio, il lattato, con il dosaggio del lattato glo. Le prestazioni di entrambi i test sono dimostrate nella nota applicativa: Glucose assay and lactate assay allow to monitor cellular glucose metabolism precisely in a cell-based assay. Nella nota applicativa: Rilevamento dei ROS in un formato basato su cellule utilizzando il saggio ROS-Glo™ di Promega, viene mostrato l'uso di un saggio basato sulla luminescenza per il rilevamento delle specie reattive dell'ossigeno prodotte in eccesso.
I recettori sono comuni bersagli farmacologici e i loro ligandi sono possibili terapie. Il legame dei ligandi ai loro recettori può essere studiato in saggi basati su cellule utilizzando il principio BRET. La luciferasi viene espressa nella parte extracellulare del recettore e un ligando viene marcato con un fluoroforo accettore adatto. Se il ligando lega il suo recettore, donatore e accettore sono sufficientemente vicini per trasferire energia e il rapporto BRET aumenta. Il metodo consente inoltre di studiare il legame al recettore di composti non marcati. Questi possono competere per il legame con un ligando noto, marcato con un fluoroforo. Se il rapporto BRET diminuisce in questa configurazione competitiva, un composto non marcato ha spostato la molecola accettore determinando una perdita di trasferimento (Fig. 9).
Il modo in cui questi saggi aiutano a studiare la farmacologia dei recettori è spiegato nel nostro intervento scientifico "Real-time profiling of receptor pharmacology".

Il principio della BRET viene utilizzato anche per studiare l'interazione tra due proteine. A tal fine, una delle proteine interagenti viene accoppiata alla luciferasi, l'altra a un fluoroforo accettore. Quando entrambe interagiscono, si verifica un trasferimento di energia che porta all'emissione del fluoroforo e a un aumento del rapporto BRET. Questo metodo può essere utilizzato, ad esempio, per studiare la dissociazione delle proteine G e il reclutamento della β-arrestina. Un metodo alternativo per studiare l'interazione utilizzando la luminescenza è l'HiBiT CETSA descritto nella nota applicativa: Measuring protein ligand binding with an endogenous HiBiT CETSA test system. Questo approccio utilizza una nanoluciferasi HiBiT frammentata fusa con una proteina bersaglio di interesse (POI) e può essere utilizzato per lo screening di PROteolysis TArgeting Chimeras (PROTACs) e di collanti molecolari nella degradazione mirata delle proteine. Questo tipo di approccio è rilevante anche per lo studio della degradazione mirata delle proteine derivante da interazioni specifiche tra degroni e ligasi noti. Mentre in condizioni fisiologiche la luciferasi frammentata può essere completata per formare un enzima funzionale con lettura luminescente, l'applicazione di un calore impedisce questo effetto a causa della denaturazione della POI. Il legame di un ligando aumenta la stabilità termica della POI, portando a uno spostamento misurabile del suo punto di fusione.
Oltre all'interazione proteina-proteina, il principio BRET può essere impiegato anche per il rilevamento di biomolecole, funzionando come biosensore. In questo esempio, è stata studiata l'attivazione differenziale delle proteine G da parte di agonisti sintetici del recettore dei cannabinoidi, utilizzando il biosensore CAMYEL BRET.
I saggi in micropiastra a luminescenza sono spesso più sensibili delle loro controparti basate su altri meccanismi. Ad esempio, i saggi ELISA luminescenti e i saggi di vitalità sono più sensibili rispettivamente dei saggi colorimetrici e di quelli basati sull'assorbanza. Inoltre, offrono soluzioni per un'ampia varietà di quesiti biologici. A causa della loro natura sensibile, sono molto utilizzati in bassi volumi in applicazioni high-throughput. Per la loro rilevazione è necessaria una strumentazione sensibile quanto il metodo stesso. Un vantaggio per l'uso non HTS della luminescenza è la disponibilità di saggi omogenei basati sul principio "add-and-measure", che rende i saggi facili e veloci da elaborare. Inoltre, una serie di saggi di luminescenza in tempo reale consente di quantificare i processi cellulari nel momento in cui si verificano.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series