
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Detecte señales bioluminiscentes flash y glow con alta sensibilidad, desde estudios de genes reporteros hasta la cuantificación de ATP.
La palabra luminiscencia se compone de «lumin» (luz en latín) y el sufijo «-escencia» (utilizado para procesos o cambios). Se trata, por tanto, de un proceso en el que se libera luz. Por definición, la luminiscencia procede de fuentes frías y se diferencia de la emisión de fuentes calentadas (incandescencia), como el hierro caliente o una vela encendida1. Las señales luminosas pueden generarse durante la conversión energética a partir de una amplia gama de fuentes de energía. El proceso convierte la energía invisible en radiación visible y puede utilizarse en la naturaleza como mecanismo de defensa, para LED en pantallas o con fines de análisis. El contenido de esta página se centra en el uso de los métodos de luminiscencia en las ciencias de la vida, explica sus antecedentes físicos, proporciona información sobre su detección en lectores de microplacas de luminiscencia y presenta ensayos comunes de microplacas de luminiscencia. La electroluminiscencia, la radioluminiscencia y la termoluminiscencia no forman parte de este contenido por no ser relevantes para este tema.
La luminiscencia es la producción de una señal luminosa mediante la conversión de energía. Su aplicación en las ciencias de la vida se basa principalmente en dos fuentes de energía: energía química o luminosa, que dan lugar a la quimioluminiscencia y la fotoluminiscencia, respectivamente. Esta última es también la base de la fluorescencia (fosforescencia).
La energía de una de las dos fuentes es absorbida por una molécula y lleva sus electrones a un nivel energético superior (Fig. 1). Como este nivel es inestable, los electrones retroceden del estado excitado al estado básico. Al retroceder, los electrones liberan energía en forma de energía vibracional, calor y fotones. Estos últimos constituyen la emisión luminiscente2.
En las ciencias de la vida, el término «fluorescencia» se utiliza habitualmente para referirse a la fosforescencia o la fotoluminiscencia, mientras que «luminiscencia» suele referirse a la quimioluminiscencia. Esta simplificación se apoya en la diferencia de detección: la fluorescencia requiere una fuente de excitación, mientras que la luminiscencia no (Fig. 2). Este contenido se adhiere a esta nomenclatura común y se concentra en la quimioluminiscencia, denominada a continuación «luminiscencia».
En esta reacción, un sustrato reacciona en un estado excitado electrónicamente. Los electrones del producto excitado o intermedio caen a su estado de menor energía emitiendo fotones, siendo por tanto luminiscente. Un ejemplo típico es la reacción del luminol en presencia de peróxido de hidrógeno (Fig. 3). En un medio alcalino, este sustrato existe en una forma (Dianión) que reacciona con el oxígeno molecular O2. El intermediario oxidado reacciona entonces a un ácido 3-aminoftálico (3-APA) electrónicamente excitado. A continuación, la molécula vuelve al estado energético que ocupa normalmente y libera luz. Este sencillo principio es también la base de la quimioluminiscencia y la bioluminiscencia potenciadas. Por tanto, ambas son también reacciones quimioluminiscentes.
La ECL utiliza potenciadores en su reacción quimioluminiscente. La ECL emplea principalmente luminol junto con peróxido de hidrógeno. Sin embargo, la oxidación es catalizada por una enzima: la peroxidasa de rábano picante (HRP). Además, las reacciones ECL contienen sustancias químicas que potencian la producción de luz, como el ácido p-cumárico o el ácido 4-yodofenilborónico. El uso de una enzima para catalizar la reacción química permite utilizar la ECL en reacciones enzimáticas. Su principal aplicación son los inmunoblots: las proteínas se separan por tamaño, se transfieren a una membrana y se detectan mediante ECL. Las proteínas de interés inmovilizadas en la membrana se unen mediante un anticuerpo específico de la proteína. Un segundo anticuerpo, acoplado a la peroxidasa de rábano picante, se utiliza para unir la proteína-anticuerpo con la enzima. Gracias a enzimas y potenciadores, se genera una señal brillante sólo donde se encuentra la proteína.
El mismo principio se emplea para la cuantificación de biomoléculas basada en microplacas. Los ensayos ELISA con lectura luminiscente tienen una mayor sensibilidad y se basan en ECL. La proteína de interés se inmoviliza en el pocillo de la microplaca y los anticuerpos específicos, el anticuerpo secundario acoplado a HRP, el sustrato y el potenciador generan una señal luminosa que aumenta con la concentración de proteína.
La bioluminiscencia se produce en los organismos vivos. El término también abarca reacciones que utilizan enzimas y sustratos derivados originalmente de organismos vivos, aunque se utilicen fuera del organismo, o bioingeniería para proporcionar características mejoradas. La bioluminiscencia se utiliza con distintos fines biológicos. Las luciérnagas utilizan su capacidad de brillar para atraer a sus parejas. Se cree que las medusas como Aequorea victoria o las gambas de aguas profundas utilizan la producción de luz para ahuyentar a sus enemigos biológicos. Durante la detección del quorum sensing, las bacterias como la marina Vibrio fischeri generan una señal luminosa cuando alcanzan una determinada densidad. Esto permite a la población comunicarse y coordinarse.
¿Cómo consiguen estos organismos la luminiscencia? Mediante una enzima (luciferasa) que cataliza la oxidación de sustratos (luciferinas) y libera así fotones. Los distintos organismos utilizan enzimas y sustratos diferentes. Además, las reacciones de emisión de luz requieren distintos cofactores y dan lugar a longitudes de onda variables. La figura 4 muestra tres reacciones de luciferasas muy utilizadas en ensayos de ciencias de la vida.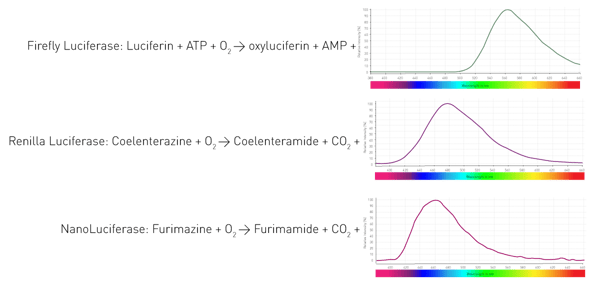
La transferencia de energía de resonancia describe la transferencia de energía de una molécula donante excitada electrónicamente a un fluoróforo aceptor. El proceso excita el fluoróforo aceptor que, a su vez, emite fotones. En el caso de que la energía donante sea generada por bioluminiscencia, el proceso se denomina transferencia de energía por resonancia de bioluminiscencia (BRET). Para que se produzca la transferencia deben cumplirse varias condiciones: el espectro de emisión de la molécula donante debe solaparse con el espectro de excitación del fluoróforo aceptor. Además, el donante y el aceptor deben estar próximos (normalmente entre 1 y 10 nm), ya que la transferencia disminuye con la distancia. Por consiguiente, la BRET se utiliza habitualmente para medir la interacción de dos biomoléculas. El resultado de la BRET es la intensidad del fluoróforo aceptor en relación con la intensidad del donante, lo que se conoce como relación BRET. BRET1, BRET2 y NanoBRET utilizan diferentes combinaciones de enzimas y fluoróforos aceptores como se muestra en la tabla 1.
Tabla 1 - Tipos de BRET
| Nombre | Luciferasa donante | Sustrato | Emisión del donante | Fluoróforo aceptor | Emisión del receptor |
| BRET 1 |
Renilla |
Coelenterazina |
450-500 nm |
YFP | 515-560 nm |
| GFP |
510-540 nm | ||||
| BRET 2 | Renilla | DeepBlueC | 400-450 nm | GFP | 500-540 nm |
| NanoBRET | NanoLuc | Furimazina | 420-500 nm | NanoBRET 618 | 550-675 nm |
| TMR | 550-600 nm | ||||
| AlexaFluor 633 | 600-700 nm | ||||
| Venus | 515-575 nm |
Los ensayos basados en la luminiscencia para aplicaciones de ciencias de la vida utilizan reacciones flash o de brillo. La diferencia entre ambas es la duración de su señal. Los ensayos flash producen una señal durante un máximo de un par de segundos. La intensidad del destello de luz producido suele registrarse directamente desde el inicio hasta el final de la reacción. Esto implica que las reacciones flash deben iniciarse mediante la adición de un iniciador de reacción. En los lectores de microplacas, se necesitan inyectores de reactivos para iniciar automáticamente la reacción y registrar la señal de forma simultánea. Los ensayos de luminiscencia flash más populares son la tecnología Dual-Luciferase Reporter™ o los ensayos SPARCL.
A diferencia de la luminiscencia flash, la luminiscencia glow genera señales estables durante horas. Los ensayos no requieren dispensación automática y pueden leerse durante más tiempo. Los investigadores, así como los proveedores de kits, tienden a preferir los ensayos de luminiscencia glow, ya que son más fáciles de manejar y detectar. Uno de los representantes más destacados de la luminiscencia glow es el ensayo de viabilidad CellTiterGlo®.
Aparte de la detección ECL en western blots, los ensayos de luminiscencia suelen emplear microplacas (formatos de 6 a 1536 pocillos) y se cuantifican utilizando un lector de microplacas. Esta sección explica cómo se mide la luminiscencia en microplacas.
La luminiscencia es más fácil de detectar que la fluorescencia o la absorbancia, ya que no requiere excitación. Esto significa que no se requiere ni una fuente de luz, ni una selección de la longitud de onda de excitación. Los componentes mínimos necesarios son una lente para recoger la señal luminosa y un detector (Fig. 5). Se requiere una herramienta de selección de longitud de onda para medir BRET y pueden ser necesarias guías de luz para construcciones de detección específicas.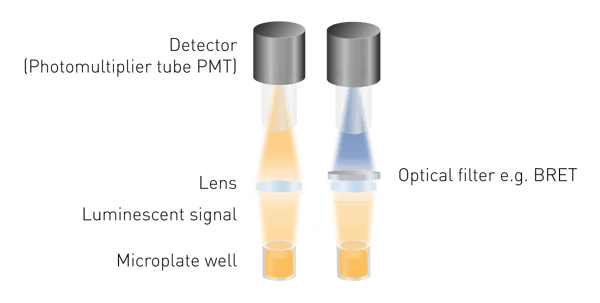
Los tubos fotomultiplicadores (PMT) sirven como detectores en la detección de luminiscencia. Los PMT difieren en su sensibilidad (la señal detectable más baja), su ruido y su capacidad para medir otros modos de detección. Muchos dispositivos de medición vienen con un PMT universal que lee la luminiscencia, así como otros modos de detección. Sus ventajas son los bajos requisitos de espacio y coste a pesar de proporcionar una alta sensibilidad. Los sistemas ópticos optimizados ofrecen la posibilidad de medir señales muy bajas. Un sistema optimizado de este tipo es el camino óptico de aire libre combinado con un módulo óptico de luminiscencia plus que se encuentra en los lectores de microplacas PHERAstar FSX.
 b) Guías de luz
b) Guías de luzLo ideal es colocar el detector directamente encima del pocillo. Si esto no es posible, es necesario guiar la señal luminosa desde el pocillo hasta el detector. Esta tarea puede realizarse mediante lentes y espejos o mediante una guía de luz. La guía absorbe parte de la luminiscencia, lo que disminuye la sensibilidad en comparación con un camino óptico de aire libre. Esta última puede encontrarse en los lectores de microplacas VANTAstar, CLARIOstar Plus y PHERAstar FSX.
Algunas aplicaciones requieren detectar sólo a una longitud de onda específica para obtener resultados óptimos. Esto se consigue mediante filtros ópticos o monocromadores colocados en el camino óptico. Las medidas BRET necesitan la selección de la longitud de onda ya que dos señales provienen de la misma muestra. Para distinguir entre la luz procedente del fluoróforo donante y la procedente del fluoróforo aceptor se necesitan dos filtros.
Los monocromadores convencionales basados en rejillas desempeñan un papel secundario en las mediciones de luminiscencia filtrada y BRET debido a su limitada sensibilidad. Esto se debe a los efectos de dispersión y a los estrechos anchos de banda. Sin embargo, una tecnología de monocromador que utiliza filtros variables lineales (LVF ) proporciona la sensibilidad necesaria. Un monocromador basado en LVF presenta una transmisión similar a la de un filtro y proporciona anchos de banda de hasta 100 nm. Esto asegura que llegue suficiente señal al detector para la luminiscencia filtrada como la BRET (Fig. 7).
Una señal luminiscente dura un segundo o más y, por lo tanto, es claramente diferente de la fluorescencia que decae en nanosegundos. En consecuencia, la señal suele detectarse durante un periodo de tiempo comprendido entre 0,1 y 1 segundos. Este tiempo recibe diferentes nombres: tiempo de medición, tiempo de integración y tiempo de intervalo de medición. Depende de varios aspectos que deben equilibrarse entre sí, como la intensidad de la señal y el tiempo total de lectura de una placa.
La detección de luminiscencia en lectores de microplacas es relativamente fácil, ya que suele requerir menos ajustes. Sin embargo, existen variables generales y relacionadas con el instrumento que afectan a las mediciones y a la calidad de los datos.
Como ya se ha indicado, el tiempo de adquisición depende de varios factores. A la hora de elegir el tiempo de integración deben tenerse en cuenta los siguientes aspectos:
La mayoría de los ensayos emiten suficiente luz para que pueda detectarse una señal entre medio segundo y 0,02 segundos. Sólo en muy raras ocasiones es necesario aumentar el tiempo de integración hasta unos segundos para detectar diferencias en las señales de luminiscencia.
Las señales de luminiscencia glow se adquieren normalmente durante 0,1 - 1 segundos, ya que emiten una señal estable. Por lo tanto, el tiempo total de lectura de la placa, así como el momento y la duración de la medición de la señal, desempeñan un papel menor. Esto es diferente en los ensayos flash. Aquí, es importante recoger la señal de emisión completa de principio a fin, que puede ser de varios segundos, dependiendo del ensayo.
Si es importante saber cómo es la curva de señal y cuál es la emisión máxima de una reacción flash, se necesitan múltiples mediciones a tiempos de integración muy bajos. Por ejemplo, si una reacción dura aproximadamente un segundo, se pueden realizar 50 mediciones de 0,02 s para cubrir un segundo y controlar cómo se desarrolla y decae la señal.
Este punto sólo es relevante para las mediciones cinéticas. En caso de que se monitorice una reacción celular o bioquímica con un ensayo luminiscente, el curso temporal de la reacción dicta el tiempo de integración. Por ejemplo, en los ensayos de calcio las respuestas se producen en un intervalo de 20 segundos después de la estimulación y pueden visualizarse mediante 10 mediciones cada 2 segundos. Si sólo se mide un pocillo, puede elegirse un tiempo de integración de 1 ó 2 s y se obtiene una resolución temporal adecuada. Sin embargo, si es necesario leer más pocillos con la misma resolución temporal (punto de medición para cada pocillo cada 2 segundos), es necesario reducir el tiempo de integración para medir los pocillos restantes y evitar la pérdida de datos.
Como el tiempo de integración se aplica a cada pocillo, contribuye en gran medida al tiempo total de lectura de una placa. Aumentar el tiempo de integración en cada pocillo en sólo 0,2 s, aumenta el tiempo total de lectura de una placa completa de 96 pocillos en 20 s, de una placa de 384 pocillos en más de un minuto. Por lo tanto, es importante utilizar tiempos de integración bajos en placas de alta densidad (placas de 384 o 1536 pocillos) y en aplicaciones de alto rendimiento en las que es necesario medir miles de placas en un día.
La ganancia puede considerarse como un factor de amplificación que desplaza una ventana de rango dinámico fija a lo largo de la curva de concentración de la muestra. Las intensidades de señal bajas requieren ganancias más altas, mientras que las señales intensas requieren ganancias más bajas. Normalmente, la ganancia se ajusta para tener una salida de medición máxima en la muestra con la intensidad más alta esperada. Esto se hace para tener la mayor ventana dinámica posible entre los valores de medición más altos y más bajos. Por lo tanto, si se utilizan controles positivos con una señal máxima junto con muestras desconocidas, la ganancia puede ajustarse en ellos.
La posibilidad de medir con diferentes ganancias que dan lugar a un gran rango dinámico permite medir señales muy bajas y emisiones brillantes con un solo instrumento.
Los ajustes de ganancia no son necesarios para todos los lectores de microplacas luminiscentes, ya que dependen del detector y de la automatización del proceso de ajuste de la ganancia.
Los lectores de placas de luminiscencia modernos realizan automáticamente los ajustes de ganancia. Esto no sólo quita esta responsabilidad al investigador, sino que también asegura a la medición un amplio rango dinámico. Tales instrumentos son el CLARIOstar® Plus y el VANTAstar® con su tecnología de rango dinámico mejorado.
Las placas blancas son las más adecuadas para la detección de luminiscencia, ya que reflejan la señal en lugar de absorberla. Encontrará más detalles sobre la elección de la placa en la entrada de nuestro blog:«La microplaca: utilidad en la práctica».
Es importante destacar que si se combinan un ensayo luminiscente y uno fluorescente en el mismo pocillo, es preferible utilizar una placa negra. La fluorescencia medida en una placa blanca da lugar a valores muy inestables y a una señal de fondo muy alta debido a la reflexión de la luz de excitación. Esto hace que la detección de fluorescencia en placas blancas sea bastante problemática. La medición de la luminiscencia en placas negras reduce la ventana de ensayo. Sin embargo, como el fondo es muy reducido y las mediciones presentan desviaciones más bajas, las mediciones deberían seguir dando resultados satisfactorios.
La diafonía (llamada también interferencia cruzada o cross-talk) es la luz procedente de un pocillo distinto del medido que el detector mide de forma inespecífica y modifica la señal del pocillo medido real. Se trata de un fenómeno que sólo afecta a la detección por luminiscencia.
Dado que la luz producida en una reacción luminiscente es difusa, no sólo puede brillar directamente sobre el pocillo, sino que también puede desviarse a los pocillos vecinos y directamente al lugar de detección, aunque se mida otro pocillo. Esto conduce a señales sesgadas, a una mayor variación y a una menor sensibilidad global. El problema puede resolverse por distintos medios, dependiendo del tipo de reacción y de la difusión de la señal.
Para los ensayos flash que sólo brillan durante unos segundos, basta con medir la placa en un orden diferente. Como la señal decae rápidamente, los únicos pocillos afectados por la diafonía son los adyacentes cuando se miden directamente uno después del otro. Si se mide un pocillo distante en lugar de uno adyacente, la diafonía disminuye drásticamente, ya que la señal que decae no es detectable en el sitio distante. Para ello, los lectores de microplacas BMG LABTECH ofrecen un modo de lectura entrelazada. Este modo mide cada dos pocillos hasta llegar al final de la placa. A continuación se miden las zonas omitidas. Esto permite que las señales medidas primero decaigan hasta que se miden sus vecinas directas.
Los ensayos glow emiten señales estables durante horas y requieren otras estrategias para eliminar la diafonía. Las señales no deseadas pueden llegar al lugar de detección por dos vías: por encima de la placa y a través de la pared de los pocillos (Fig. 8). Ambas vías deben abordarse de forma diferente.
Las aperturas bloquean físicamente la luz no deseada que llega al detector a través de los pocillos. Una apertura es un accesorio negro en forma de cuchara con un orificio que se coloca encima de la microplaca (Fig. 8). A través del orificio, la señal del pocillo de interés llega al detector, mientras que toda la luz procedente de su entorno queda físicamente bloqueada. Los lectores de microplacas multimodo PHERAstar®FSX de BMG LABTECH, así como VANTAstar® y CLARIOstar® Plus vienen con orificios para mejorar la detección de luminiscencia.
 b) Reducción de la diafonía matemática
b) Reducción de la diafonía matemáticaLa luz puede atravesar la pared de plástico de un pocillo, incluso en microplacas blancas. El tipo de microplaca afecta significativamente a la diafonía que se produce a través de las paredes de la placa. Por lo general, las placas de mayor densidad (por ejemplo, 1536 pocillos) presentan una mayor fuga de luz a través de las paredes que las placas de menor densidad, ya que las paredes son más finas. Un segundo aspecto es la geometría de los pocillos: los pocillos cuadrados tienen una mayor diafonía a través de las paredes porque los pocillos adyacentes comparten una pared. Los pocillos redondos no comparten la pared y, por lo tanto, presentan una menor diafonía a través de la pared. Además, el color de la placa influye en la diafonía a través de las paredes de la microplaca: cuanto más oscura es la placa, menor es la diafonía. Las placas grises ofrecen un compromiso entre la reducción de la diafonía y la reflexión de la señal.
Si no es posible optimizar más la placa, se puede aplicar una reducción matemática de la diafonía a los datos adquiridos. Para ello, se determina el paso de la señal a los pocillos vecinos y un algoritmo corrige los datos. Los lectores de placas PHERAstar®FSX, VANTAstar® y CLARIOstar®Plus de BMG LABTECH disponen de un sistema automático de determinación y corrección de la diafonía.
Las placas blancas tienen una fosforescencia intrínseca: la propia placa emite luz tras la exposición a la luz. Esta señal puede alterar los datos, aumentando los blancos y reduciendo la ventana de ensayo. Por lo tanto, se recomienda preparar la placa en la oscuridad o dejar la placa en la oscuridad aproximadamente 15 minutos antes de la medición.
Los filtros son necesarios principalmente para las mediciones BRET. Dado que la luminiscencia suele mostrar una señal de salida baja, se recomienda utilizar filtros con un ancho de banda amplio de 80 - 100 nm. Los anchos de banda más amplios hacen que llegue más luz al detector y aumentan la sensibilidad de la medición.
Los ensayos reporteros utilizan secuencias reguladoras de genes combinadas con la información genética de una molécula reportera para estudiar cambios en la expresión génica o modificaciones en la propia región reguladora. La información genética del gen informador debe introducirse en las células. Si el gen informador está activo, la enzima se transcribe y se traduce. En presencia de un sustrato, se convierte, se produce luz y su emisión informa sobre la actividad de las secuencias reguladoras.
Los ensayos de reportero de luciferasa dual (DLR™) añaden un segundo reportero al sistema. Junto al acoplado a una secuencia reguladora de interés, una segunda luciferasa controlada por un promotor constitutivo (o de mantenimiento) sirve como control interno. Utilizando el CLARIOstar o el VANTAstar y su opción de barrido de luminiscencia es posible identificar luciferasas coincidentes y combinar, por ejemplo, hasta seis luciferasas en un único ensayo de luciferasa multiplexado.
El ensayo de viabilidad más popular se basa en la enzima luciérnaga. Su actividad aumenta con el incremento de los niveles de ATP, al igual que la emisión de luz. Las células viables producen ATP, que tras la lisis celular alimenta la reacción. En consecuencia, la emisión se correlaciona con el número de células y la viabilidad. Además de los ensayos de viabilidad de punto final basados en ATP, los ensayos luminiscentes pueden medir la viabilidad celular en tiempo real. Para ello, se añaden al cultivo celular un pro-sustrato y la enzima luciérnaga. El pro-sustrato es reducido únicamente por las células viables y, a continuación, se procesa en una reacción emisora de luz. De este modo, la luminiscencia informa de los cambios de viabilidad en tiempo real. Puede obtener más información sobre estos ensayos en nuestra charla científica «Los ensayos de salud celular en tiempo real ofrecen mejores datos con menos esfuerzo». Los ensayos de viabilidad celular también son relevantes para el trabajo con PROteolysis TArgeting Chimeras (PROTACs) y pegamentos moleculares en la degradación dirigida de proteínas para el descubrimiento de fármacos. Esto incluye la investigación sobre la degradación selectiva de proteínas a partir de interacciones específicas entre degrones y ligasas conocidos.

El metabolismo celular abarca diferentes etapas de conversión molecular. Muchos de los ensayos disponibles para detectar las vías metabólicas celulares se basan en la luminiscencia. El metabolismo básico se centra en el uso de los principales nutrientes, como la glucosa. El consumo de glucosa puede rastrearse, por ejemplo, mediante el ensayo glucosa-glo. Para la medición indirecta del consumo de glucosa, el producto de descomposición de la glucosa, el lactato, también puede detectarse con el ensayo lactato-glo. El rendimiento de ambos ensayos se demuestra en la nota de aplicación: Glucose assay and lactate assay allow to monitor cellular glucose metabolism precisely in a cell-based assay. En la nota de aplicación: ROS detection in a cell-based format using the Promega ROS-Glo™ assay, se muestra el uso de un ensayo basado en luminiscencia para la detección de especies reactivas del oxígeno producidas en exceso.
Los receptores son dianas farmacológicas comunes y sus ligandos son posibles terapias. La unión de los ligandos a sus receptores puede estudiarse en ensayos celulares utilizando el principio BRET. La luciferasa se expresa en la parte extracelular del receptor y se marca un ligando con un fluoróforo aceptor adecuado. Si el ligando se une a su receptor, el donante y el aceptor están lo suficientemente cerca como para transferir energía y la relación BRET aumenta. El método permite además estudiar la unión al receptor de compuestos no marcados. Estos pueden competir por la unión con un ligando conocido, marcado con un fluoróforo. Si la relación BRET disminuye en una configuración competitiva de este tipo, un compuesto no marcado desplaza a la molécula aceptora, lo que provoca una pérdida de transferencia (Fig. 9).
El modo en que estos ensayos ayudan a estudiar la farmacología de los receptores se explica en nuestra charla científica «Real-time profiling of receptor pharmacology».

El principio de la BRET también se utiliza para estudiar la interacción de dos proteínas. Para ello, una de las proteínas que interactúa se acopla a la luciferasa y la otra a un fluoróforo aceptor. Tras la interacción de ambas, se produce una transferencia de energía que conduce a la emisión del fluoróforo y a un aumento del índice BRET. Esto puede utilizarse, por ejemplo, para estudiar la disociación de la proteína G y el reclutamiento de la β-arrestina. Un método alternativo para estudiar la interacción utilizando luminiscencia es el HiBiT CETSA descrito en la nota de aplicación: Measuring protein ligand binding with an endogenous HiBiT CETSA test system. Este enfoque utiliza una nanoluciferasa HiBiT fragmentada fusionada a una proteína diana de interés (POI, por sus siglas en inglés) y se puede utilizar para cribar quimeras PROteolysis TArgeting (PROTACs) y pegamentos moleculares en la degradación de proteínas diana. Este tipo de enfoque también es relevante para el estudio de la degradación dirigida de proteínas derivada de interacciones específicas entre degrones y ligasas conocidos. Mientras que en condiciones fisiológicas la luciferasa fragmentada puede completarse para formar una enzima funcional con lectura luminiscente, la aplicación de calor impide este efecto debido a la desnaturalización de la proteína de interés (POI). La unión de un ligando aumentará la estabilidad térmica de la POI, dando lugar a un desplazamiento medible de su punto de fusión.
Además de la interacción proteína-proteína, el principio BRET también puede emplearse para la detección de biomoléculas, funcionando como un biosensor. En este ejemplo, se estudió la activación diferencial de proteínas G por agonistas sintéticos de receptores cannabinoides, utilizando el biosensor CAMYEL BRET.
Los ensayos de microplacas de luminiscencia son a menudo más sensibles que sus homólogos basados en otros mecanismos. Por ejemplo, los ensayos ELISA luminiscentes y los ensayos de viabilidad son más sensibles que los ensayos colorimétricos y los basados en la absorbancia, respectivamente. Además, ofrecen soluciones para una amplia variedad de cuestiones biológicas. Debido a su naturaleza sensible, son muy utilizados en volúmenes bajos en aplicaciones de alto rendimiento. Para su detección se necesita una instrumentación tan sensible como el propio método. Una ventaja para el uso no HTS de la luminiscencia es la disponibilidad de ensayos homogéneos basados en un principio de adición y medida que hace que los ensayos sean fáciles y rápidos de procesar. Además, una variedad de ensayos de luminiscencia en tiempo real permite la cuantificación de los procesos celulares a medida que ocurren.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series