
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Liberate la potenza della TR-FRET per saggi altamente sensibili e omogenei nella scoperta di farmaci, interazioni biomolecolari e ricerca cellulare.
La FRET risolta nel tempo (TR-FRET) è una tecnologia di rilevamento che combina la fluorescenza risolta nel tempo (TRF) con il trasferimento di energia di risonanza di Förster (FRET). La TR-FRET è utilizzata principalmente per analizzare gli eventi di legame e per lo screening di farmaci ad alto rendimento.
Il trasferimento di energia di risonanza di Förster descrive un trasferimento di energia tra due fluorofori. Prende il nome dallo scienziato tedesco Theodor Förster che originariamente sviluppò la teoria del trasferimento di energia di risonanza.1 Perché avvenga, un fluoroforo donatore che ha assorbito energia durante l'eccitazione e si trova in uno stato elettronicamente eccitato, trasferisce energia a un secondo fluoroforo accettore. Il trasferimento di energia riduce l'intensità di emissione del donatore e aumenta quella dell'accettore.
Il trasferimento di energia dipende da due condizioni. In primo luogo, la vicinanza spaziale tra donatore e accettore deve essere compresa tra 20 e 90 Å. Il trasferimento di energia di risonanza è inversamente proporzionale alla sesta potenza della distanza donatore-accettore, quindi è molto sensibile alle variazioni di distanza. In secondo luogo, è necessaria una sovrapposizione tra lo spettro di emissione del donatore e lo spettro di eccitazione dell'accettore. Le "coppie FRET" richiedono una distanza sufficiente tra i picchi di emissione per essere otticamente distinguibili, ma allo stesso tempo una sovrapposizione spettrale sufficiente per consentire un trasferimento efficiente di energia (fig. 1A).
In biologia, le proteine fluorescenti geneticamente codificate sono le più utilizzate. Le più diffuse sono la proteina fluorescente verde (GFP), la proteina fluorescente rossa (RFP), la proteina fluorescente ciano (CFP) e la proteina fluorescente gialla (YFP)2.
La FRET viene generalmente utilizzata per studiare interazioni molecolari o eventi di legame e può essere impiegata per determinare l'affinità di legame didue partner. La valutazione avviene collegando ciascun partner di legame da studiare a un fluoroforo e rilevando il livello di trasferimento di energia che avviene (fig. 1 B, C). Tuttavia, poiché la FRET standard è influenzata negativamente dal rumore di fondo derivato dalla luce di eccitazione diffusa e dall'autofluorescenza, è difficile ottenere misure altamente sensibili con questo approccio.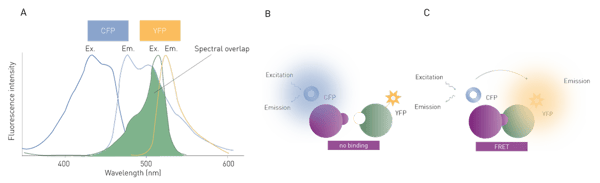
La FRET risolta nel tempo elimina il rumore di fondo di breve durata derivato dalla luce di eccitazione diffusa e dall'autofluorescenza grazie all'adozione della fluorescenza risolta nel tempo e all'introduzione di una rilevazione ritardata nel tempo. Ciò è possibile grazie all'uso dei lantanoidi come donatori. Questi fluorofori hanno grandi spostamenti di Stokes e tempi di vita di emissione fino a millisecondi.
La TR-FRET si basa sul trasferimento di energia di risonanza tra un lantanoide e un fluoroforo a vita breve, quando sono vicini. Grazie a queste proprietà, presenta una maggiore stabilità e specificità rispetto alla FRET standard. L'interferenza del tampone o del mezzo è significativamente ridotta dalla fluorescenza a lunga vita e dalla rilevazione raziometrica delle due lunghezze d'onda di emissione del donatore e dell'accettore.
Il principio generale di applicazione di questa tecnologia è molto simile tra i diversi produttori di kit, tra i quali i più noti sono HTRF®, LANCE®, LanthaScreenTM e THUNDERTM. Il donatore e l'accettore sono legati covalentemente ai partner interagenti oppure un anticorpo specifico contro ciascuno dei due target (o tag) è marcato con il donatore o l'accettore. Eccitando il donatore, l'energia viene trasferita all'accettore, che emette grazie al trasferimento di energia di risonanza di fluorescenza, se i target sono vicini. L'emissione è proporzionale alla quantità di legame che avviene.
Nella TR-FRET vengono utilizzati diversi fluorofori, che formano coppie diverse, a seconda del produttore.
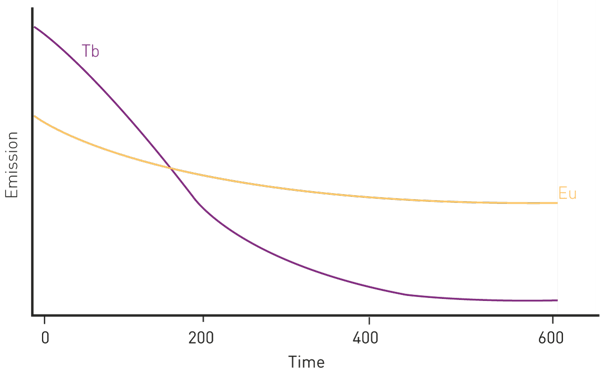
I lantanoidi sono tipicamente eccitati a 320 - 340 nm. L'emissione dell'europio viene solitamente rilevata a 620 nm, mentre il terbio può essere rilevato a 490 o 620 nm a seconda del kit e del produttore. Per gli accettori, l'emissione è a 520 nm per i fluorofori verdi o a 665 nm per quelli rossi. L'emissione del donatore viene utilizzata come riferimento interno, mentre l'emissione dell'accettore è un indicatore del trasferimento di energia (evento di legame) in corso (fig. 3).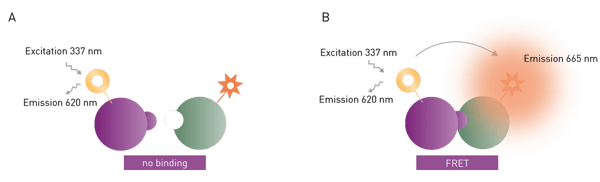
Tra l'eccitazione e la rilevazione della fluorescenza viene applicato un ritardo temporale dell'ordine dei microsecondi. In questo modo si elimina la fluorescenza di fondo aspecifica a vita breve. L'emissione viene quindi solitamente rilevata in un periodo di tempo (finestra di misurazione) di microsecondi (fig. 4). A seconda del kit e del produttore, le impostazioni del ritardo temporale e della finestra di misurazione possono variare.
Viene quindi calcolato un rapporto tra i segnali integrati nel tempo dei due canali di emissione. Questa misura raziometrica normalizza il segnale, elimina le interferenze del mezzo e il quenching e corregge gli errori di manipolazione dei liquidi o la variabilità da pozzetto a pozzetto.
La sensibilità e la versatilità hanno reso i saggi TR-FRET molto popolari. La combinazione di rivelazione a risoluzione temporale e misurazioni raziometriche aumenta significativamente la finestra di analisi e riduce il background. Inoltre, l'emissione dei lantanidi non decade, è stabile nel tempo ed è compatibile con diversi reagenti e condizioni sperimentali.
Nonostante questi vantaggi, il principale vantaggio di questo metodo è probabilmente che la rilevazione della coppia legata non richiede la separazione fisica dai componenti non legati per ridurre il background. Essendo un saggio cosiddetto omogeneo, la TR-FRET non richiede fasi di lavaggio intermedie e può essere eseguita come un semplice saggio add-and-read (fig. 5), riducendo al minimo le fasi di manipolazione e risultando più conveniente e meno dispendiosa in termini di tempo rispetto agli ELISA. Di conseguenza, è particolarmente adatto per le campagne di screening HTS automatizzate.
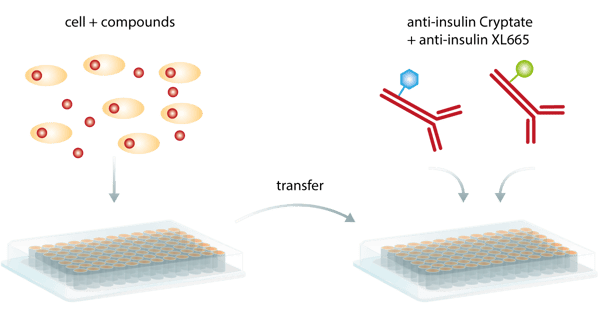
Tuttavia, il quenching del segnale generato da interazioni esterne con il processo di eccitazione intramolecolare o la fluorescenza dei composti della libreria o delle proteine biologiche può rappresentare una limitazione.3
I kit per il dosaggio TR-FRET sono disponibili presso diversi produttori. Sebbene tutti i test siano basati su una tecnologia comune e possano essere rilevati su un lettore di micropiastre, esistono differenze tra i kit e i produttori. Queste sono principalmente legate ai diversi tipi di donatori e accettori, alle loro combinazioni e alle diverse tempistiche per l'inizio del rilevamento e la finestra di misurazione.
Tutte le tecnologie di dosaggio e le loro caratteristiche, compresi i picchi di eccitazione e di emissione, sono riassunte nella tabella 1. Oltre alle caratteristiche descritte, questi kit variano anche nei tempi di intervallo e nelle finestre di analisi.
Tabella 1: confronto tra i kit di analisi TR-FRET più diffusi e i relativi picchi di eccitazione ed emissione
| Kit | Donatore | Tipo di gabbia | Eccitazione | Emissione | Accettore | Emissione |
| LANCE | Europio | Chelato | 320 nm | 620 nm | ULightTM | 665 nm |
| LANCE | Europio | Chelato | 320 nm | 620 nm | Surelight® APC | 665 nm |
| LanthaScreen Eu | Europio | Chelato | 320 nm | 620 nm | AlexaFluor 647 | 665 nm |
| LanthaScreen Tb | Terbio | Chelato | 340 nm | 490 nm | Fluoresceina/GFP | 520 nm |
| Rosso HTRF (Eu) | Europio | Criptato | 320 nm | 620 nm | XL665/d2 | 665 nm |
| Rosso HTRF (Tb) | Terbio | Criptato | 340 nm | 620 nm | XL665/d2 | 665 nm |
| Verde HTRF (Tb) | Terbio | Criptato | 340 nm | 620 nm | Fluoresceina/GFP | 520 nm |
| Transcreener TR-FRET | Terbio | Chelato | 340 nm | 620 nm | HiLyte647 | 665 nm |
| THUNDER | Chelato di | europio | 320 nm | 620 nm | Colorante rosso lontano | 665 nm |
Oltre all'uso di kit disponibili in commercio, le coppie donatore-accettore TR-FRET possono anche essere combinate liberamente, purché lo spettro di emissione del donatore mostri una sufficiente sovrapposizione con lo spettro di eccitazione dell'accettore, come mostrato in AN 388: Legame differenziale dei derivati del ∆9-tetraidrocannabinolo ai recettori cannabinoidi di tipo 1 (CB1).
La rilevazione FRET risolta nel tempo viene eseguita prevalentemente su lettori di micropiastre. La configurazione di base di un lettore di micropiastre TR-FRET consiste in una sorgente di luce, filtri di eccitazione e di emissione per la selezione della lunghezza d'onda e un rivelatore a tubo fotomoltiplicatore (PMT). Oltre alla modalità di rilevamento TRF, i lettori di piastre devono essere in grado di misurare due canali di emissione in un'unica corsa, in sequenza o simultaneamente. Poiché la TR-FRET è utilizzata principalmente nello screening ad alta produttività, la compatibilità con le micropiastre a 384 e 1536 pozzetti è generalmente obbligatoria.
I complessi chelati o criptati sono tipicamente eccitati a 320 - 340 nm. Pertanto, come sorgente luminosa si può utilizzare sia una lampada flash allo xeno sia un laser a eccitazione specifica. Un laser TRF concentra una maggiore energia su questo specifico intervallo di lunghezze d'onda e porta a risultati migliori con una migliore discriminazione tra segnali bassi e alti.
Il PHERAstar FSX è dotato di un laser TRF con una frequenza di lampeggio di 60 Hertz, che offre un vantaggio significativo in termini di velocità per la rilevazione TR-FRET. Il laser consente di misurare un'intera piastra da 1536 pozzetti in 36 secondi, mantenendo uno Z´ > 0,8 per i saggi cellulari e biochimici (fig. 7), come illustrato nella nota applicativa "Saggi HTRF cellulari e biochimici misurati in micropiastre da 1536 pozzetti".
Nella nota applicativa Excellent assay performance of THUNDER™ TR-FRET cell-based cytokine assays performed on the PHERAstar FSX, viene mostrato come il PHERAstar FSX con laser TRF mostri una sensibilità e un range dinamico molto più elevati rispetto a un lettore di micropiastre HTS concorrente.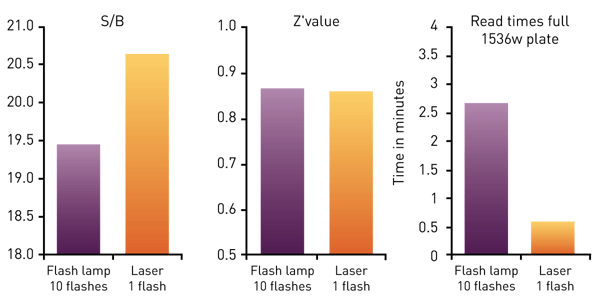
Il PHERAstarFSX è dotato di rivelatori a conteggio di fotoni (PMT) per la rivelazione TR-FRET. I normali rivelatori forniscono in uscita un valore di integrazione per l'area sotto la curva durante il tempo di integrazione. I PMT a conteggio di fotoni contano invece ogni singolo fotone, monitorando così l'intera curva di decadimento del lantanide.
Sul lettore PHERAstar FSX, il rilevamento a conteggio di fotoni consente di misurare e visualizzare la curva di decadimento dell'emissione con una risoluzione temporale di 2 microsecondi. Questa caratteristica unica, chiamata Monitoraggio della curva di decadimento, semplifica lo sviluppo del saggio e aiuta a ottimizzare i parametri di temporizzazione, migliorando la rilevazione e riducendo il background. Insieme all'Integration Wizard, Decay Curve Monitoring offre una piattaforma per l'ottimizzazione dei dosaggi TR-FRET.
È necessario rilevare le due lunghezze d'onda di emissione, in sequenza o simultaneamente. In genere, i lettori di micropiastre misurano le due emissioni una dopo l'altra. La rilevazione simultanea presenta tuttavia diversi vantaggi.
Il sistema di rivelazione Simultaneous Dual Emission (SDE) del PHERAstarFSX utilizza due PMT abbinati per la misurazione parallela delle due lunghezze d'onda di emissione. In questo modo, SDE dimezza i tempi di lettura e aumenta la produttività, correggendo al contempo le variazioni causate da differenze di volume di riempimento, concentrazioni o fluttuazioni dell'energia di eccitazione. Queste caratteristiche si traducono in una maggiore sensibilità e in una minore %CV. Le misure SDE a canale singolo vengono combinate per il calcolo raziometrico dei risultati di entrambi i canali di emissione.
Nello screening dei farmaci, il downscaling dei saggi è un passo fondamentale. La miniaturizzazione mira a ridurre i volumi dei campioni mantenendo la riproducibilità, l'affidabilità e la robustezza del saggio. I saggi possono essere ridotti a piastre da 3456 pozzetti, ma i formati più comuni sono quelli da 384 e 1536 pozzetti.
I dosaggi TR-FRET possono essere miniaturizzati mantenendo accuratezza e riproducibilità, poiché l'intensità del segnale non dipende dalla quantità di tracciante ma dalla sua concentrazione. Ciò è ulteriormente supportato dall'uso di un lettore di piastre altamente sensibile come il PHERAstarFSX.
Nell'intervento scientifico "Successfully downscaling screening assays: Servier´s experience", presentiamo un caso di studio in cui il lettore di piastre PHERAstar FSX ha contribuito in modo significativo alla miniaturizzazione di un saggio HTRF dal formato a 384 a quello a 1536 pozzetti. Sul PHERAstarFSX, la miniaturizzazione è stata combinata con l'ulteriore diluizione dei reagenti e con la rivelazione "al volo" (un solo flash per pozzetto). Ciò ha permesso di ottenerevalori Z´ di alta qualità e di ridurre in modo significativo l'uso di reagenti e il consumo di tempo.

La TR-FRET viene utilizzata per analizzare gli eventi di legame nei saggi biochimici. Inoltre, è adatto a saggi basati su cellule, poiché le misurazioni dei lisati cellulari possono essere eseguite in presenza di un mezzo di coltura (rilevamento omogeneo).
Le diverse impostazioni biologiche comprendono interazioni proteina-DNA/RNA, legame proteina-proteina (ligando-recettore), chinasi e vie di segnalazione, compresi GPCR, citochine e biomarcatori.
La TR-FRET è particolarmente apprezzata nella comunità dello screening dei farmaci per la sua sensibilità, la maggiore produttività, l'affidabilità e la flessibilità, nonché per il minor numero di risultati falsi positivi o falsi negativi.
Le interazioni molecolari tra proteine e tra proteine e acidi nucleici avvengono a tutti i livelli della cellula. Queste includono l'epigenetica (ad esempio, l'attività di modifica degli istoni, dove possono essere utilizzate per studiare l'inibizione delle istone deacetilasi), la trasduzione del segnale (ad esempio, l'attivazione delle proteine G), la comunicazione cellulare (ad esempio, l'interazione ligando-recettore), la regolazione genica, ecc. Le interazioni proteina-proteina giocano un ruolo cruciale anche nel funzionamento delle PROteolysis TArgeting Chimeras (PROTACs) o colle molecolari, piccole molecole che indirizzano selettivamente le proteine indesiderate al sistema di smaltimento delle proteine della cellula (sistema ubiquitina-proteasoma). I ricercatori possono scegliere tra diverse opzioni per i saggi di degradazione delle proteine basati sulle cellule. Per la degradazione mirata delle proteine da parte dei PROTAC e delle colle molecolari, è possibile eseguire in micropiastra tecniche come AlphaScreen®, Time-Resolved Fluorescence Resonance Energy Transfer (TR-FRET) o metodi di luminescenza come NanoBRET™ per misurare l'interazione tra bersaglio e ligasi. Queste tecniche possono essere utilizzate anche per studiare la degradazione mirata delle proteine derivante da interazioni specifiche tra degroni e ligasi noti.
In questa testimonianza, Nick Bland dell'azienda Domainex spiega come il PHERAstar FSX supporti la sua ricerca biochimica con valori Z` di 0,9 nelle campagne HTS TR-FRET.

L'attività delle chinasi viene analizzata principalmente con saggi sandwich che misurano la variazione di fosforilazione di un substrato, come illustrato nella nota applicativaAnalisi della fosforilazione di ERK1/2, p38αβγ e STAT3 con i saggi immunologici per chinasi cellulari THUNDER™ TR-FRET. È possibile utilizzare anche saggi di competizione per monitorare i diversi prodotti generati dalla reazione (ad es. ADP). In alternativa, si utilizza un substrato chinasi marcato in modo fluorescente e un anticorpo antifosfo marcato con lantanidi (fig. 8), come mostrato nella nota applicativa "LanthaScreen TR-FRET tyrosine kinase and protein kinase C assay". Questi metodi possono essere applicati anche alle proteasi e all'ubiquitinazione. Per ulteriori informazioni sul rilevamento dell'attività delle chinasi, visitate il nostro blog "Kinase assays".
I saggi per lo studio deirecettori accoppiati a proteine G (GPCR) possono essere di tipo meccanicistico o funzionale. I saggi funzionali si concentrano principalmente sulla quantificazione dei messaggeri secondari (ad esempio IP1 o cAMP), che possono accumularsi nella cellula in seguito all'attività di inibitori specifici. Di conseguenza, i secondi messaggeri vengono utilizzati come lettura, poiché la loro concentrazione è correlata al legame con il ligando e all'impegno del recettore. Ciò è illustrato nelle note applicative "Saggio HTRF IP-One utilizzato per lo screening funzionale" e "L'attivazione dei GPCR viene misurata utilizzando il saggio cellulare cAMP e IP1 HTRF HTplex di Cisbio". I saggi meccanicistici si concentrano sull'organizzazione e sull'oligomerizzazione dei recettori sulla membrana cellulare per mediare la segnalazione.
L'analisi dei prodotti di segnalazione a valle può essere utilizzata per identificare percorsi aberranti, che potrebbero avere un ruolo nelle malattie neurologiche, metaboliche e infiammatorie. La FRET risolta nel tempo può essere utilizzata per testare l'efficacia di composti specificamente mirati a queste malattie. Esempi di applicazione includono "Sviluppo di un rapido test HTRF per l'insulina" per le malattie metaboliche, in particolare il diabete mellito, "Rilevazione dell'aggregazione della proteina tau umana" nellemalattie neurodegenerative edeccellenti prestazioni del test THUNDER™ TR-FRET basato sulle cellule, eseguito su PHERAstar FSX per la quantificazione dellecitochine in diverse malattie.
Nell'intervento scientifico Targeting the type 1 cholecystokinin receptor to screen for novel obesity treatments viene illustrato come un saggio TR-FRET sia stato utilizzato per analizzare l'accumulo di inositolo monofosfato, un metabolita a valle dell'IP3. Sulla base di questi risultati è stato sviluppato un ulteriore saggio di legame basato su TR-FRET.

A causa di difficoltà tecniche e di un throughput relativamente basso, la cinetica del legame ligando-recettore è stata tradizionalmente studiata in un momento tardivo della scoperta di un farmaco. Tuttavia, la scoperta di farmaci trarrebbe grande beneficio dalla loro ottimizzazione, poiché i tassi diKon e Koff hanno un impatto sull'efficienza, sulla comparsa di effetti collaterali, sull'efficacia e sulla durata d'azione. Inoltre, la cinetica di legame sembra avere un ruolo nell'agonismo distorto. È quindi auspicabile esaminare la cinetica di legame dei candidati farmaci in una fase iniziale, prima di passare ai modelli in vivo e agli studi clinici.
Gli studi di cinetica di legame (fig. 9) possono essere eseguiti in modo efficiente su lettori di piastre che consentono la rilevazione cinetica TR-FRET per scopi di screening e lo studio cinetico di composti a bassa affinità, come discusso nella relazione scientifica "A TR-FRET approach to measure the kinetics of ligand-receptor binding and its application of fragment screening" (Un approccio TR-FRET per misurare la cinetica del legame ligando-recettore e la sua applicazione nello screening dei frammenti) e nella nota applicativa "Analyze binding kinetics with HTRF" (Analizzare la cinetica di legame con HTRF).

Le sue caratteristiche uniche, dedicate agli studi di legame cinetico, rendono il PHERAstar FSX superiore a qualsiasi altro lettore di micropiastre attualmente sul mercato. Il lettore è in grado di risolvere facilmente gli eventi di legame e di calcolare i tassi Kon e Koff grazie all'elevata risoluzione temporale nella rilevazione TR-FRET e alle soluzioni hardware/software dedicate.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows