
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Decubra todo el potencial de TR-FRET para ensayos altamente sensibles y homogéneos en el descubrimiento de fármacos, las interacciones biomoleculares y la investigación celular.
La FRET de resolución temporal (TR-FRET) es una tecnología de detección que combina la fluorescencia de resolución temporal (TRF) con la transferencia de energía de resonancia de Förster (FRET). TR-FRET se utiliza principalmente para analizar fenómenos de unión y para el cribado de fármacos de alto rendimiento.
La transferencia de energía de resonancia de Förster describe una transferencia de energía entre dos fluoróforos. Recibe su nombre del científico alemán Theodor Förster, quien desarrolló originalmente la teoría de la transferencia de energía de resonancia1. Para que tenga lugar, un fluoróforo donante que ha absorbido energía durante la excitación y se encuentra en un estado electrónicamente excitado, transfiere energía a un segundo fluoróforo aceptor. La transferencia de energía reduce la intensidad de emisión del donante y aumenta la del aceptor.
La transferencia de energía depende de dos condiciones. En primer lugar, la proximidad espacial entre el donante y el aceptor debe estar comprendida entre 20 y 90 Å. La transferencia de energía de resonancia es inversamente proporcional a la sexta potencia de la distancia entre el donante y el aceptor, por lo que es muy sensible a los cambios de distancia. En segundo lugar, se requiere un solapamiento entre el espectro de emisión del donante y el espectro de excitación del aceptor. Los «pares FRET» requieren una distancia suficiente entre los picos de emisión para ser ópticamente distinguibles, pero al mismo tiempo un solapamiento espectral suficiente para permitir una transferencia de energía eficiente (fig. 1A).
En biología, las proteínas fluorescentes codificadas genéticamente son las más utilizadas. Las más populares son la proteína verde fluorescente (GFP), la proteína roja fluorescente (RFP), la proteína cian fluorescente (CFP) y la proteína amarilla fluorescente (YFP).2
La FRET se utiliza generalmente para estudiar interacciones moleculares o eventos de unión y puede emplearse para determinar la afinidad de unión de dos socios de unión. La FRET se utiliza generalmente para estudiar interacciones moleculares o eventos de unión y se puede emplear para determinar la afinidad de unión de dos socios de unión, que se evalúan vinculando cada socio de unión a investigar a un fluoróforo y detectando el nivel de transferencia de energía que tiene lugar (fig. 1 B, C). Sin embargo, dado que la FRET estándar se ve afectada negativamente por el ruido de fondo derivado de la luz de excitación dispersa y la autofluorescencia, difícilmente se pueden obtener mediciones altamente sensibles con este enfoque.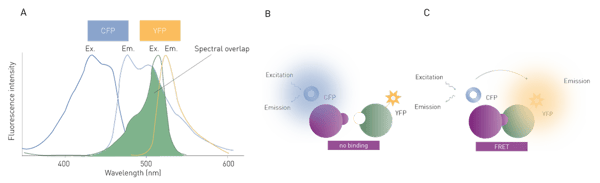
La FRET resuelta en el tiempo elimina el ruido de fondo de corta duración derivado de la dispersión de la luz de excitación y de la autofluorescencia gracias a la adopción de la fluorescencia de resolución en el tiempo y a la introducción de una detección retardada en el tiempo. Esto es posible gracias al uso de lantánidos como donantes. Estos fluoróforos tienen grandes desplazamientos de Stokes y tiempos de emisión de hasta milisegundos.
La TR-FRET se basa en la transferencia de energía de resonancia que tiene lugar entre un lantánido y un fluoróforo de vida corta, cuando están próximos. Debido a estas propiedades, ha mejorado la estabilidad y la especificidad con respecto a la FRET estándar. La interferencia del tampón o del medio se reduce significativamente por la fluorescencia de larga duración y por la detección ratiométrica de las dos longitudes de onda de emisión del donante y del aceptor.
El principio general de aplicación de esta tecnología es muy similar en los distintos fabricantes de kits, entre los que destacan HTRF®, LANCE®, LanthaScreenTM y THUNDERTM. El donante y el aceptor se unen covalentemente a las partes que interactúan o se marca un anticuerpo específico contra cada una de las dos dianas (o etiquetas) con el donante o el aceptor. Al excitar el donante, la energía se transfiere al aceptor, que emite por transferencia de energía de resonancia de fluorescencia si las dianas están próximas. La emisión es proporcional a la cantidad de unión que tiene lugar.
En la TR-FRET se utilizan diferentes fluoróforos que forman diferentes pares, dependiendo del fabricante.
Los lantánidos suelen excitarse a 320 - 340 nm. La emisión del europio se detecta normalmente a 620 nm, mientras que la del terbio puede detectarse a 490 o 620 nm dependiendo del kit y del fabricante. Para los aceptores, la emisión es de 520 nm para los fluoróforos verdes o de 665 nm para los rojos. La emisión del donante se utiliza como referencia interna, mientras que la emisión del aceptor es un indicador de la transferencia de energía (evento de unión) que tiene lugar (fig. 3).
Entre la excitación y la detección de fluorescencia se aplica un retardo de tiempo del orden de microsegundos. De este modo se elimina la fluorescencia de fondo inespecífica de corta duración. La emisión se detecta entonces normalmente durante un periodo de tiempo (ventana de medición) de microsegundos (fig. 4). Dependiendo del kit y del fabricante, los ajustes del retardo temporal y de la ventana de medición pueden variar.
A continuación, se calcula una relación de las señales integradas en el tiempo de los dos canales de emisión. Esta medición ratiométrica normaliza la señal, elimina las interferencias del medio y la extinción, y corrige los errores de manipulación de líquidos o la variabilidad entre pocillos.
La sensibilidad y la versatilidad han hecho que los ensayos TR-FRET sean muy populares. La combinación de detección resuelta en el tiempo y mediciones ratiométricas aumenta significativamente la ventana de ensayo y reduce el fondo. Además, la emisión de lantánidos apenas se decolora, es estable en el tiempo y compatible con diferentes reactivos y condiciones experimentales.
A pesar de estos beneficios, la mayor ventaja de este método es probablemente que la detección del par unido no requiere separación física de los componentes no unidos para reducir el fondo. Como ensayo homogéneo, el TR-FRET no necesita pasos de lavado intermedios y puede realizarse como un simple ensayo de adición y lectura (fig. 5), minimizando los pasos de manipulación y siendo más conveniente y consumiendo menos tiempo que los ELISA. En consecuencia, es especialmente adecuado para campañas automatizadas de cribado HTS.
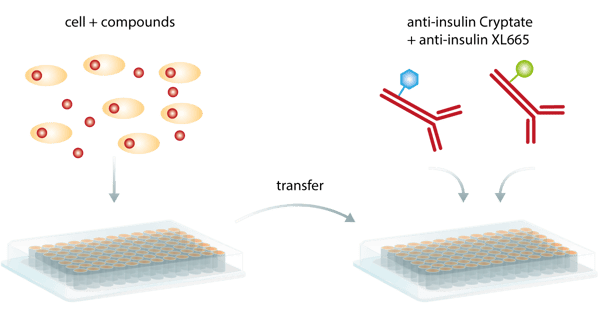
Sin embargo, el apagado de la señal generado por interacciones externas con el proceso de excitación intramolecular o la fluorescencia de los compuestos de la biblioteca o las proteínas biológicas puede suponer una limitación3.
Existen kits de ensayo TR-FRET de diferentes fabricantes. Aunque todos los ensayos se basan en una tecnología común y todos pueden detectarse en un lector de microplacas, existen diferencias entre los kits y los fabricantes. Éstas están relacionadas principalmente con los diferentes tipos de donantes y aceptores, sus combinaciones y los diferentes tiempos para el inicio de la detección y la ventana de medición.
En la tabla 1 se resumen todas las tecnologías de ensayo y sus características, incluidos los picos de excitación y emisión. Además de las características descritas, estos kits varían también en sus tiempos de intervalo y ventanas de ensayo.
Tabla 1: comparación de los kits de ensayo TR-FRET más populares y sus picos de excitación y emisión
| Kit | Donante | Tipo de jaula | Excitación | Emisión | Aceptor | Emisión |
| LANCE | Europio | Quelato | 320 nm | 620 nm | ULightTM | 665 nm |
| LANCE | Europio | Quelato | 320 nm | 620 nm | Surelight® APC | 665 nm |
| LanthaScreen Eu | Europio | Quelato | 320 nm | 620 nm | AlexaFluor 647 | 665 nm |
| LanthaScreen Tb | Terbio | Quelato | 340 nm | 490 nm | Fluoresceína/GFP | 520 nm |
| HTRF Rojo (Eu) | Europio | Criptato | 320 nm | 620 nm | XL665/d2 | 665 nm |
| HTRF Rojo (Tb) | Terbio | Criptato | 340 nm | 620 nm | XL665/d2 | 665 nm |
| Verde HTRF (Tb) | Terbio | Criptato | 340 nm | 620 nm | Fluoresceína/GFP | 520 nm |
| Transcreener TR-FRET | Terbio | Quelato | 340 nm | 620 nm | HiLyte647 | 665 nm |
| THUNDER | Europio | Quelato | 320 nm | 620 nm | Colorante rojo lejano | 665 nm |
Además del uso de kits disponibles comercialmente, los pares donante y aceptor TR-FRET también pueden combinarse libremente, siempre que el espectro de emisión del donante muestre un solapamiento suficiente con el espectro de excitación del aceptor, como se muestra en AN 388: Differential binding of ∆9-tetrahydrocannabinol derivatives to type 1 cannabinoid receptors (CB1).
La detección FRET resuelta en el tiempo se realiza predominantemente en lectores de microplacas. La configuración básica de un lector de placas TR-FRET consiste en una fuente de luz, filtros de excitación y emisión para la selección de la longitud de onda y un detector de tubo fotomultiplicador (PMT). Además del modo de detección TRF, los lectores de placas tienen que ser capaces de medir dos canales de emisión en una pasada, ya sea secuencial o simultáneamente. Dado que la TR-FRET se utiliza principalmente en el cribado de alto rendimiento, la compatibilidad con microplacas de 384 y 1536 pocillos suele ser obligatoria.
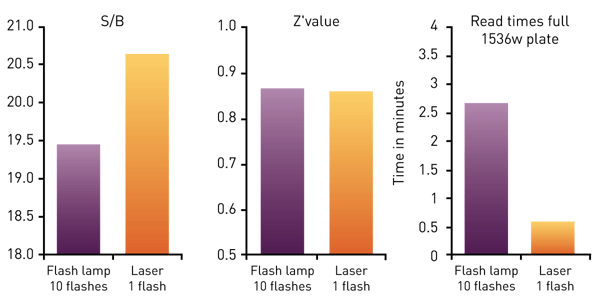
Los complejos de quelato o criptato suelen excitarse a 320 - 340 nm. Por lo tanto, como fuente de luz se puede utilizar tanto una lámpara de flash de xenón como un láser de excitación específico. Un láser TRF concentra más energía en este rango específico de longitudes de onda y permite obtener mejores resultados con una mejor discriminación entre señales bajas y altas.
El PHERAstar FSX está equipado con un láser TRF con una frecuencia de destello de 60 hercios, lo que proporciona una ventaja de velocidad significativa para la detección TR-FRET. El láser permite la medición de una placa completa de 1536 pocillos en 36 segundos manteniendo una Z' > 0,8 para ensayos celulares y bioquímicos (fig. 7), como se muestra en la nota de aplicación «Cellular and biochemical HTRF assays measured in 1536-well microplates» (Ensayos HTRF celulares y bioquímicos medidos en microplacas de 1536 pocillos).
En la nota de aplicación Excellent assay performance of THUNDER™ TR-FRET cell-based cytokine assays performed on the PHERAstar FSX, se muestra cómo el PHERAstar FSX con láser TRF exhibe una sensibilidad y un rango dinámico mucho mayores que un lector de microplacas HTS de la competencia.
El PHERAstar FSX está equipado con detectores de recuento de fotones (PMT) para la detección TR-FRET. Los detectores ordinarios proporcionan como salida un valor de integración para el área bajo la curva durante el tiempo de integración. En cambio, los PMT de recuento de fotones cuentan cada fotón individual y, por lo tanto, monitorizan toda la curva de decaimiento del lantánido.
En el lector PHERAstar FSX, la detección por recuento de fotones permite medir y mostrar la curva de decaimiento de la emisión con una resolución temporal de 2 microsegundos. Esta función exclusiva, denominada monitorización de la curva de decaimiento, simplifica el desarrollo del ensayo y ayuda a optimizar los parámetros de temporización, mejorando la detección y reduciendo el fondo. Junto con el asistente de integración, la monitorización de la curva de decaimiento ofrece una plataforma para la optimización de ensayos TR-FRET.
Se requiere la detección de las dos longitudes de onda de emisión, ya sea secuencial o simultáneamente. Comúnmente, los lectores de microplacas miden las dos emisiones una tras otra. Sin embargo, la detección simultánea tiene varias ventajas.
El sistema de detección de doble emisión simultánea (SDE) del PHERAstar FSX utiliza dos PMT emparejados para la medición paralela de las 2 longitudes de onda de emisión. De esta forma, el SDE reduce los tiempos de lectura a la mitad y aumenta el rendimiento, al tiempo que corrige las variaciones causadas por las diferencias en el volumen de relleno, las concentraciones o las fluctuaciones en la energía de excitación. Estas características mejoran la sensibilidad y reducen los %CV. Las mediciones SDE de un solo canal se combinan para el cálculo ratiométrico de los resultados de ambos canales de emisión.
En el cribado de fármacos, la reducción de escala del ensayo es un paso clave. El objetivo de la miniaturización es reducir los volúmenes de muestra manteniendo la reproducibilidad, fiabilidad y robustez del ensayo. Los ensayos pueden reducirse a placas de 3456 pocillos, aunque los formatos más comunes son los de 384 y 1536 pocillos.
Los ensayos TR-FRET pueden miniaturizarse manteniendo la precisión y la reproducibilidad, ya que la intensidad de la señal no depende de la cantidad de un trazador, sino de su concentración. Esto se ve reforzado por el uso de un lector de placas de alta sensibilidad como el PHERAstar FSX.
En la charla científica «Successfully downscaling screening assays: Servier's experience», presentamos un estudio de caso en el que el lector de placas PHERAstar FSX contribuyó significativamente a la miniaturización de un ensayo HTRF del formato de 384 pocillos al de 1536 pocillos. En el PHERAstar FSX, la miniaturización se combinó con la dilución adicional de reactivos y con la detección «sobre la marcha» (solo un flash por pocillo). Esto dio lugar a valores Z' de alta calidad y a una reducción significativa del uso de reactivos y del consumo de tiempo.

La TR-FRET se utiliza para analizar eventos de unión en ensayos bioquímicos. Además, es adecuada para ensayos celulares, ya que las mediciones de lisados celulares pueden realizarse en presencia de un medio de cultivo (detección homogénea).
Los diferentes escenarios biológicos incluyen interacciones proteína-ADN/ARN, unión proteína-proteína (ligando-receptor), quinasas y vías de señalización incluyendo GPCRs, citoquinas y biomarcadores.
TR-FRET es particularmente popular en la comunidad de cribado de fármacos debido a su sensibilidad, mayor rendimiento, fiabilidad y flexibilidad, y menos resultados falsos positivos o falsos negativos.
Las interacciones moleculares entre proteínas y entre proteínas y ácidos nucleicos tienen lugar en todos los niveles de la célula. Entre ellas se incluyen la epigenética (por ejemplo, la actividad modificadora de las histonas, donde pueden utilizarse para investigar la inhibición de las desacetilasas de histonas), la transducción de señales (por ejemplo, la activación de proteínas G), la comunicación celular (por ejemplo, la interacción ligando-receptor), la regulación génica, etc. Las interacciones proteína-proteína también desempeñan un papel crucial en el funcionamiento de las PROteolysis TArgeting Chimeras (PROTACs) o pegamentos moleculares, pequeñas moléculas que dirigen selectivamente las proteínas no deseadas al sistema de eliminación de proteínas de la célula (sistema ubiquitina-proteasoma). Los investigadores pueden elegir entre distintas opciones para los ensayos de degradación celular de proteínas. Para la degradación dirigida de proteínas mediante PROTACs y ligasas moleculares, pueden realizarse en microplacas técnicas como AlphaScreen®, Transferencia de energía por resonancia fluorescente de resolución temporal (TR-FRET) o métodos de luminiscencia como NanoBRET™ para medir la interacción entre la diana y la ligasa. Estas técnicas también pueden utilizarse para estudiar la degradación de proteínas diana derivada de interacciones específicas entre degrones y ligasas conocidos.
En este testimonio, Nick Bland de la empresa Domainex comenta cómo el PHERAstar FSX apoya su investigación bioquímica con valores Z` de 0,9 en campañas basadas en HTS TR-FRET.

La actividad quinasa se analiza principalmente con ensayos tipo sándwich que miden el cambio de fosforilación de un sustrato, como se muestra en la nota de aplicación Análisis de la fosforilación de ERK1/2, p38αβγ y STAT3 con los inmunoensayos de quinasas celulares THUNDER™ TR-FRET. También pueden emplearse ensayos de competición para monitorizar diferentes productos generados por la reacción (por ejemplo, ADP). Alternativamente, se utiliza un sustrato de quinasa marcado con fluorescencia y un anticuerpo antifosfo marcado con lantánidos (fig. 8), como se muestra en la nota de aplicación «LanthaScreen TR-FRET tyrosine kinase and protein kinase C assay». Estos métodos también pueden aplicarse a las proteasas y a la ubiquitinación. Para más información sobre la detección de la actividad de las quinasas, visite nuestra entrada del blog «Ensayos de quinasas».
Los ensayos para estudiar los receptores acoplados a proteínas G (GPCR) pueden ser mecánicos o funcionales. Los ensayos funcionales se centran principalmente en la cuantificación de mensajeros secundarios (por ejemplo, IP1 o AMPc), ya que éstos pueden acumularse en la célula como consecuencia de la actividad de inhibidores específicos. En consecuencia, los segundos mensajeros se utilizan como indicador, ya que su concentración se correlaciona con la unión del ligando y la participación del receptor. Esto se muestra en las notas de aplicación «HTRF IP-One assay used for functional screening» y «GPCR activation is measured using Cisbio's cAMP and IP1 HTRF HTplex cell-based assay». Los ensayos mecánicos se centran en la organización y oligomerización del receptor en la membrana celular para mediar la señalización.
El análisis de los productos de la señalización descendente puede utilizarse para identificar vías aberrantes, que posiblemente desempeñen un papel en enfermedades neurológicas, metabólicas e inflamatorias. La FRET resuelta en el tiempo puede utilizarse para probar la eficacia de compuestos dirigidos específicamente a estas enfermedades. Entre los ejemplos de aplicación se incluyen el «Desarrollo de un ensayo rápido de insulina HTRF» para enfermedades metabólicas, en particular la diabetes mellitus, la «Detección de la agregación de la proteína tau humana» en enfermedades neurodegenerativas y el excelente rendimiento de los ensayos de citoquinas basados en células THUNDER™ TR-FRET realizados en el PHERAstar FSX para la cuantificación de citoquinas en diferentes enfermedades.
En la charla científica «Targeting the type 1 cholecystokinin receptor to screen for novel obesity treatments» se explica cómo se utilizó un ensayo TR-FRET para detectar la acumulación de monofosfato de inositol, un metabolito derivado del IP3. A partir de estos resultados, se desarrolló un ensayo de unión basado en TR-FRET.

Debido a las dificultades técnicas y al relativamente bajo rendimiento, la cinética de la unión ligando-receptor se ha estudiado tradicionalmente en un momento tardío del descubrimiento de fármacos. Sin embargo, el descubrimiento de fármacos se beneficiaría enormemente de su optimización, ya que las tasasKon y Koff influyen en la eficacia, la aparición de efectos secundarios y la eficacia y duración de la acción. Además, la cinética de unión parece desempeñar un papel en el agonismo sesgado. Por lo tanto, es deseable examinar la cinética de unión de los fármacos candidatos en una fase temprana, antes de pasar a los modelos in vivo y a los estudios clínicos.
Los estudios de cinética de unión (fig. 9) pueden realizarse eficazmente en lectores de placas que permiten la detección cinética TR-FRET con fines de cribado y el estudio cinético de compuestos de baja afinidad, como se explica en la charla científica «A TR-FRET approach to measure the kinetics of ligand-receptor binding and its application of fragment screening» y en la nota de aplicación «Analyze binding kinetics with HTRF».

Sus características únicas dedicadas a los estudios de unión cinética, hacen que el PHERAstar FSX sea superior a cualquier otro lector de microplacas actualmente en el mercado. El lector puede resolver fácilmente los eventos de unión y calcular las tasas Kon y Koff gracias a su alta resolución temporal en la detección TR-FRET y a las soluciones hardware/software dedicadas.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows