
PHERAstar FSX
Powerful and most sensitive HTS plate reader


리포터 유전자 연구부터 ATP 정량화까지, 고감도로 플래시 및 발광 생체 발광 신호를 감지합니다.
루미네선스이라는 단어는 라틴어로 빛을 뜻하는 '루민'과 프로세스 또는 변화에 사용되는 접미사 '-에센스'로 구성되어 있습니다. 따라서 발광은 빛이 방출되는 과정을 의미합니다. 정의에 따르면 발광은 차가운 광원에서 비롯되며 뜨거운 다리미나 타는 양초와 같은 가열된 광원(백열등)에서 방출되는 것과 구별됩니다1. 발광 신호는 광범위한 에너지원에서 에너지 변환 중에 생성될 수 있습니다. 이 과정은 보이지 않는 에너지를 눈에 보이는 방사선으로 바꾸며, 자연에서 방어 메커니즘, 스크린의 LED 또는 분석 목적으로 사용될 수 있습니다. 이 페이지의 내용은 생명 과학에서 발광 방법의 사용에 초점을 맞추고, 그 물리적 배경을 설명하고, 발광 마이크로플레이트 판독기에서의 검출에 대한 정보를 제공하고, 일반적인 발광 마이크로플레이트 분석법을 제시합니다. 전기 발광, 방사 발광 및 열 발광은 이 주제와 관련이 없으므로 이 콘텐츠에 포함되지 않습니다.
발광은 에너지 변환을 통해 발광 신호를 생성하는 것입니다. 생명 과학에서의 응용은 주로 화학 에너지 또는 발광 에너지라는 두 가지 에너지원에 의존하며, 각각 화학 발광과 광 발광으로 이어집니다. 광 발광은 형광과 인광의 기반이기도 합니다.
두 광원 중 하나의 에너지는 분자에 흡수되어 전자를 더 높은 에너지 준위로 끌어올립니다(그림 1). 이 준위는 불안정하기 때문에 전자는 들뜬상태에서 바닥 상태로 되돌아갑니다. 바닥 상태로 떨어질 때 전자는 진동 에너지, 열, 광자의 형태로 에너지를 방출합니다. 이 중 광자 방출이 발광입니다2.
생명 과학에서 '형광'은 인광 또는 광발광을 말할 때 일반적으로 사용되는 반면 '발광'은 일반적으로 화학 발광을 의미합니다. 형광은 여기광이 필요하지만 발광은 그렇지 않다는 점에서 이러한 단순화는 감지의 차이로 뒷받침됩니다(그림 2). 이 콘텐츠는 이러한 일반적인 명명법을 준수하며 화학 발광에 초점을 맞추어 이를 "발광"이라고 합니다.
이 반응에서 기판은 전자적으로 여기된 상태로 반응합니다. 여기된 생성물 또는 중간체의 전자는 광자를 방출하여 가장 낮은 에너지 상태로 떨어지며, 따라서 발광합니다. 대표적인 예로 과산화수소가 있을 때 루미놀의 반응을 들 수 있습니다(그림 3). 알칼리성 환경에서 이 기질은 분자 산소 O2와 반응하는 형태(다이이온)로 존재합니다. 그런 다음 산화된 중간체는 전자적으로 여기된 3-아미노프탈산(3-APA)과 반응합니다. 그러면 분자는 원래의 에너지 상태로 되돌아가 빛을 방출합니다. 이 간단한 원리는 향상된 화학 발광 및 생물 발광의 기초이기도 합니다. 따라서 두 가지 모두 화학 발광 반응입니다.
ECL은 화학 발광 반응에 강화제를 사용합니다. ECL은 주로 과산화수소와 함께 루미놀을 사용합니다. 그러나 산화는 효소인 홀세라디시 퍼옥시다제(HRP)에 의해 촉매됩니다. 또한 ECL 반응에는 p-쿠마르산 또는 4-요오도페닐보론산과 같이 빛 생산을 향상시키는 화학 물질이 포함되어 있습니다. 화학 반응을 촉매하기 위해 효소를 사용하면 효소 연결 반응에 ECL을 사용할 수 있습니다. 주요 응용 분야는 면역 블롯으로, 단백질을 크기별로 분리하여 멤브레인으로 옮긴 후 ECL로 검출합니다. 멤브레인에 고정된 관심 단백질은 단백질 특이 항체에 의해 결합됩니다. 홀스래디시 퍼옥시다제 결합 이차 항체는 단백질-항체를 효소와 연결하는 데 사용됩니다. 효소와 강화제 덕분에 단백질이 발견된 곳에서만 밝은 신호가 생성됩니다.
생체 분자의 마이크로 플레이트 기반 정량화에도 동일한 원리가 사용됩니다. 발광 판독을 사용하는ELISA 분석은 감도가 더 높으며 ECL을 기반으로 합니다. 관심 있는 단백질이 마이크로 플레이트에 잘 고정되고 특정 항체, HRP 결합 이차 항체, 기질 및 증강제가 단백질 농도에 따라 증가하는 발광 신호를 생성합니다.
생체 발광은 살아있는 유기체에서 발생합니다. 이 용어는 원래 생물체에서 유래한 효소와 기질을 사용하는 반응도 포함하지만, 생물체 외부에서 사용되거나 향상된 특성을 제공하기 위해 생체 공학적으로 설계된 반응도 포함합니다. 생물발광은 다양한 생물학적 목적으로 사용됩니다. 반딧불이는 빛을 발산하는 능력을 이용해 짝을 찾습니다. 해파리나 심해 새우와 같은 생물은 생물학적 적을 쫓기 위해 빛을 내는 것으로 알려져 있습니다. 해양 비브리오 피셔와 같은 박테리아는 정족수감지중에 특정 밀도에 도달하면 발광 신호를 생성합니다. 이를 통해 개체군은 서로 소통하고 조율할 수 있습니다.
이 유기체는 어떻게 발광할 수 있을까요? 기질(루시페린)의 산화를 촉매하여 광자를 방출하는 효소(루시페라아제)를 통해 발광합니다. 유기체마다 사용하는 효소와 기질은 다릅니다. 또한 발광 반응에는 서로 다른 보조 인자가 필요하며 그 결과 다양한 파장이 발생합니다. 그림 4는 생명과학 분석에서 널리 사용되는 세 가지 루시퍼라제의 반응을 보여줍니다.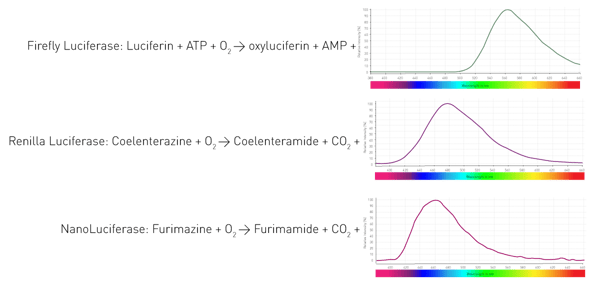
공명 에너지 전달은 전자적으로 여기된 공여체 분자에서 억셉터 형광체로 에너지가 전달되는 것을 설명합니다. 이 과정은 억셉터 형광체를 여기시켜 광자를 방출합니다. 생체 발광에 의해 공여체 에너지가 생성되는 경우, 이 과정을 생체 발광 공명 에너지 전달(BRET)이라고 합니다. 공여체 분자의 방출 스펙트럼이 억셉터 형광체의 여기 스펙트럼과 겹쳐야 하는 등 다양한 조건이 충족되어야 전달이 가능합니다. 또한 거리가 멀어질수록 전달이 감소하기 때문에 공여체와 수용체는 근접(일반적으로 1-10nm)해야 합니다. 따라서 BRET는 일반적으로 두 생체 분자의 상호 작용을 측정하는 데 사용됩니다. BRET의 출력은 공여체의 강도와 관련된 억셉터 형광체의 강도이며, 이를 BRET 비율이라고 합니다. BRET1, BRET2 및 NanoBRET은 표 1과 같이 효소와 억셉터 형광체의 서로 다른 조합을 사용합니다.
표 1 - BRET의 유형
| 이름 | 기증자 루시퍼라제 | 기질 | 기증자 방출 | 수용체 형광체 | 억셉터 방출 |
| BRET 1 |
Renilla |
코엘렌테라진 |
450-500nm |
YFP | 515-560 nm |
| GFP |
510-540nm | ||||
| BRET 2 | Renilla | DeepBlueC | 400-450nm | GFP | 500-540nm |
| NanoBRET | NanoLuc | Furimazine | 420-500nm | NanoBRET 618 | 550-675 nm |
| TMR | 550-600 nm | ||||
| AlexaFluor 633 | 600-700nm | ||||
| Venus | 515-575 nm |
생명과학 분야의 발광 기반 분석은 플래시 또는 글로우 반응을 사용합니다. 이 둘의 차이점은 신호의 지속 시간입니다. 플래시 분석은 최대 몇 초 동안 신호를 생성합니다. 생성된 광섬광의 강도는 일반적으로 반응의 시작부터 끝까지 직접 기록됩니다. 즉, 플래시 반응은 반응 스타터를 추가하여 시작해야 합니다. 마이크로 플레이트 리더기에서는 자동으로 반응을 시작하고 동시에 신호를 기록하기 위해 시약 주입기가 필요합니다. 널리 사용되는 플래시 발광 분석법으로는Dual-Luciferase Reporter™ 기술또는SPARCL 분석법이 있습니다.
플래시와 달리 글로우 발광은 최대 몇 시간 동안 안정적인 신호를 생성합니다. 이 분석은 자동 디스펜싱이 필요하지 않으며 장시간에 걸쳐 판독할 수 있습니다. 키트 제공업체뿐만 아니라 연구자들은 취급과 검출이 더 쉽기 때문에 글로우 분석을 선호하는 경향이 있습니다. 글로우 발광의 가장 대표적인 제품 중 하나는 생존력 테스트인 CellTiterGlo®입니다.
웨스턴 블롯에서의 ECL 검출과는 별도로, 발광 테스트는 일반적으로 마이크로플레이트 (6~1536웰 형식)를 사용하며 마이크로플레이트 판독기를 사용하여 정량화합니다. 이 섹션에서는 마이크로플레이트에서 발광을 측정하는 방법을 설명합니다.
발광은 여기가 필요하지 않기 때문에 형광이나 흡광도보다 감지하기가 더 쉽습니다. 즉, 광원이나 여기 파장을 선택할 필요가 없습니다. 필요한 최소 구성 요소는 발광 신호를 수집하는 렌즈와 검출기뿐입니다(그림 5). BRET를 측정하려면 파장 선택 도구가 필요하며 특정 감지 구조에 따라 광 가이드가 필요할 수 있습니다.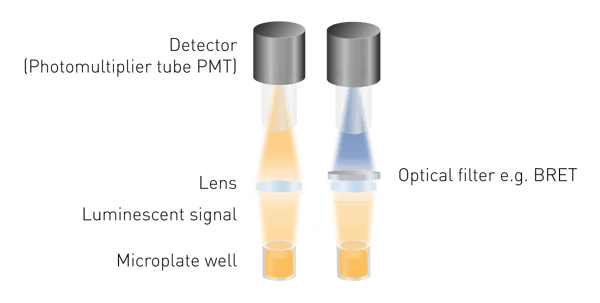
광증배관(PMT)은 발광 검출에서 검출기 역할을 합니다. PMT는 감도(감지 가능한 최저 신호), 노이즈 및 다른 감지 모드를 측정할 수 있는 기능이 다릅니다. 많은 측정 장치에는 발광뿐만 아니라 다른 감지 모드도 판독하는 범용 PMT가 함께 제공됩니다. 높은 감도를 제공하면서도 공간과 비용이 적게 든다는 장점이 있습니다. 최적화된 광학 시스템을 통해 매우 낮은 신호도 측정할 수 있습니다. 이러한 최적화된 시스템은 PHERAstar FSX 마이크로 플레이트 판독기에 있는 발광 플러스 광학 모듈과 결합된 자유 공기 광학 경로입니다.
발광 감지를 위한 전용 PMT는 노이즈가 더 낮거나 광자 카운팅 원리를 사용합니다. 두 전용 PMT 모두 낮은 신호도 감지할 수 있지만, 광자 카운팅 시스템은 높은 신호를 감지하는 데 제한이 있습니다(그림 6).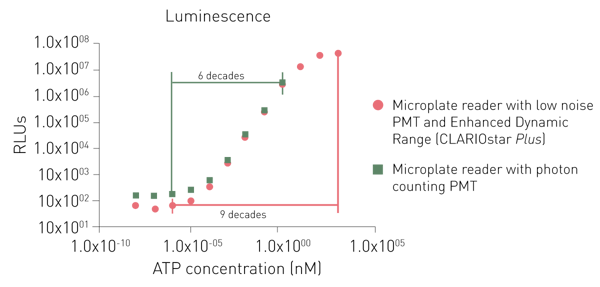
감지기는 웰 바로 위에 배치하는 것이 이상적입니다. 이것이 가능하지 않은 경우, 발광 신호를 웰에서 검출기로 유도해야 합니다. 이 작업은 렌즈와 거울 또는 라이트 가이드를 통해 수행할 수 있습니다. 가이드는 발광의 일부를 흡수하여 자유 공기 광학 경로에 비해 감도를 감소시킵니다. 후자는 VANTAstar, CLARIOstar Plus및 PHERAstar FSX마이크로 플레이트 리더기에서 찾을 수 있습니다.
일부 애플리케이션은 최적의 결과를 위해 특정 파장에서만 감지해야 합니다. 이는 광학 경로에 광학 필터 또는 모노크로메이터를 배치하여 수행됩니다. BRET 측정은 하나의 동일한 시료에서 두 개의 신호가 나오기 때문에 파장 선택이 필요합니다. 공여체에서 나오는 빛과 억셉터 형광체에서 나오는 빛을 구별하려면 두 개의 필터가 필요합니다.
기존의 격자 기반 모노크로메이터는 감도가 제한적이기 때문에 필터 발광 및 BRET 측정에서 보조적인 역할을 합니다. 이는 산란 효과와 좁은 대역폭 때문입니다. 그러나 선형 가변 필터(LVF)를사용하는 모노크로메이터 기술은 필요한 감도를 제공합니다. LVF 기반 모노크로메이터는 필터와 같은 전송을 나타내며 최대 100nm의 대역폭을 제공합니다. 이를 통해 BRET와 같은 필터 발광을 위해 충분한 신호가 감지기에 도달하도록 보장합니다(그림 7).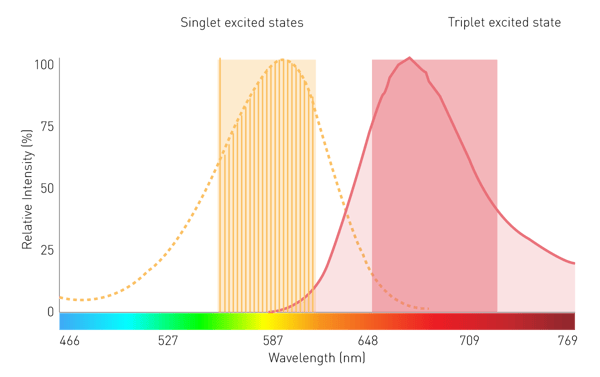
발광 신호는 1초 이상 지속되므로 나노초 단위로 소멸하는 형광과는 분명한 차이가 있습니다. 따라서 신호는 일반적으로 0.1초에서 1초 사이의 시간 동안 감지됩니다. 이 시간은 측정 시간, 적분 시간, 측정 간격 시간 등 다양한 이름으로 불립니다. 이는 신호 강도 및 플레이트 판독에 걸리는 총 시간 등 서로 균형을 맞춰야 하는 여러 측면에 따라 달라집니다.
마이크로 플레이트 리더기에서 발광 감지는 일반적으로 설정이 덜 필요하기 때문에 비교적 쉽습니다. 그러나 측정 및 데이터 품질에 영향을 미치는 기기 관련 및 일반적인 변수가 있습니다.
위에서 설명한 것처럼 수집 시간은 여러 요인에 따라 달라집니다. 적분 시간을 선택할 때는 다음과 같은 측면을 고려해야 합니다:
대부분의 분석은 0.01초에서 0.02초 내에 신호를 감지할 수 있을 만큼 충분한 빛을 방출합니다. 아주 드물게 발광 신호의 차이를 감지하기 위해 적분 시간을 몇 초까지 늘려야 하는 경우가 있습니다.
글로우 신호는 안정적인 신호를 방출하므로 일반적으로 0.1~1초 동안 수집됩니다. 따라서 총 플레이트 판독 시간과 신호 측정 타이밍 및 지속 시간은 사소한 역할을 합니다. 플래시 분석에서는 다릅니다. 여기에서는 분석에 따라 몇 초가 걸릴 수 있는 전체 방출 신호를 처음부터 끝까지 수집하는 것이 중요합니다.
신호 곡선의 모양과 플래시 반응의 최대 방출량을 아는 것이 중요한 경우 매우 짧은 적분 시간에서 여러 번 측정해야 합니다. 예를 들어 반응에 약 1초가 걸리는 경우, 1초 동안 0.02초씩 50회 측정하여 신호가 어떻게 발생하고 소멸하는지 모니터링할 수 있습니다.
이 점은 동역학 측정에만 관련이 있습니다. 발광 분석법으로 세포 기반 또는 생화학 반응을 모니터링하는 경우 반응의 시간 경과에 따라 통합 시간이 결정됩니다. 예를 들어, 칼슘 분석에서 반응은 자극 후 20초 범위에서 발생하며 2초마다 10회 측정하여 표시할 수 있습니다. 하나의 웰만 측정하는 경우 1초 또는 2초의 적분 시간을 선택하여 적절한 시간 분해능을 얻을 수 있습니다. 그러나 동일한 시간 분해능(2초마다 각 웰의 측정 지점)으로 더 많은 웰을 판독해야 하는 경우, 나머지 웰을 측정하고 데이터 손실을 방지하기 위해 적분 시간을 줄여야 합니다.
적분 시간은 각 웰에 적용되므로 플레이트의 총 판독 시간에 크게 기여합니다. 각 웰의 적분 시간을 0.2초만 늘리면 전체 96웰 플레이트의 전체 판독 시간은 20초, 384웰 플레이트의 판독 시간은 1분 이상 증가합니다. 따라서 고밀도 플레이트(384 또는 1536 웰 플레이트)와 하루에 수천 개의 플레이트를 측정해야 하는 고처리량 애플리케이션에서는 짧은 적분 시간을 사용하는 것이 중요합니다.
게인은 시료의 농도 곡선을 따라 고정된 동적 범위 창을 이동시키는 증폭 계수로 간주할 수 있습니다. 신호 강도가 낮을수록 더 높은 게인이 필요하고, 신호가 강할수록 더 낮은 게인이 필요합니다. 일반적으로 게인은 예상되는 가장 높은 강도의 샘플에서 최대 측정 출력을 갖도록 설정됩니다. 이는 최고 측정값과 최저 측정값 사이에 가능한 가장 큰 동적 창을 갖기 위해 수행됩니다. 따라서 최대 신호가 있는 포지티브 컨트롤을 알 수 없는 샘플과 함께 사용하는 경우 게인을 조정할 수 있습니다.
다양한 게인으로 측정할 수 있어 동적 범위가 넓기 때문에 하나의 장비로 매우 낮은 신호와 밝은 방출을 측정할 수 있습니다.
모든 발광 마이크로플레이트 판독기에 게인 설정이 필요한 것은 아니며, 검출기 및 게인 조정 프로세스의 자동화에 따라 다릅니다.
최신발광 플레이트 리더기는 게인 조정을 자동으로수행합니다. 이는 연구자의 부담을 덜어줄 뿐만 아니라 넓은 동적 범위를 측정할 수 있도록 보장합니다. 이러한 기기로는향상된 다이나믹 레인지기술이 적용된CLARIOstar® Plus와VANTAstar®가 있습니다.
흰색 플레이트는 신호를 흡수하는 대신 반사하기 때문에 발광 감지에 가장 적합합니다. 플레이트 선택에 대한 자세한 내용은 블로그 게시물에서 확인할 수 있습니다:"마이크로 플레이트: 실제에서의 유용성."
중요한 점은 발광 분석과 형광 분석을 동일한 웰에 결합하는 경우 검은색 플레이트가 선호된다는 것입니다. 흰색 플레이트에서 측정한 형광은 여기광의 반사로 인해 매우 불안정한 값과 매우 높은 배경 신호로 이어집니다. 따라서 흰색 플레이트에서의 형광 검출은 상당히 문제가 됩니다. 검은색 플레이트에서 발광을 측정하면 분석 창이 줄어듭니다. 그러나 배경이 크게 감소하고 측정 편차가 낮기 때문에 여전히 만족스러운 결과를 얻을 수 있습니다.
크로스 토크는 측정된 우물을 제외한 모든 우물에서 나오는 빛이 감지기에 의해 구체적으로 측정되지 않고 실제 측정된 우물의 신호를 수정하는 것을 말합니다. 이는 발광 감지에만 영향을 미치는 현상입니다.
발광 반응에서 생성된 빛은 확산되기 때문에 다른 유정을 측정하더라도 유정 바로 위에서 빛날 뿐만 아니라 인접한 유정 및 감지 지점으로 직접 비출 수 있습니다. 이로 인해 신호가 편향되고 변동이 커지며 전반적인 감도가 낮아집니다. 이 문제는 반응 유형과 신호의 확산에 따라 다양한 방법으로 해결할 수 있습니다.
몇 초 동안만 빛을 발하는 플래시 분석의 경우, 다른 순서로 플레이트를 측정하는 것으로 충분합니다. 신호가 빠르게 감쇠하기 때문에 서로 바로 다음에 측정할 때 크로스 토크의 영향을 받는 웰은 인접한 웰뿐입니다. 인접한 유정 대신 멀리 떨어진 유정을 측정하면 멀리 떨어진 곳에서는 감쇠 신호를 감지할 수 없으므로 크로스 토크가 크게 감소합니다. 이를 위해 비엠지랩텍 마이크로플레이트 판독기는 인터레이스 판독 모드를 제공합니다. 이 모드는 플레이트의 끝에 도달할 때까지 모든 웰을 측정합니다. 그런 다음 생략된 영역이 측정됩니다. 이렇게 하면 먼저 측정된 신호가 바로 옆의 신호가 측정될 때까지 감쇠할 수 있습니다.
글로우 테스트는 몇 시간 동안 안정적인 신호를 방출하므로 혼선을 제거하기 위한 다른 전략이 필요합니다. 원하지 않는 신호는 플레이트 위와 우물 벽을 통해 두 가지 방법으로 탐지 지점에 도달할 수 있습니다(그림 8). 두 가지 방법 모두 다르게 접근해야 합니다.
조리개는 웰을 통해 감지기로 비추는 원치 않는 빛을 물리적으로 차단합니다. 조리개는 구멍이 뚫린 검은색 숟가락 모양의 액세서리로 마이크로 플레이트 위에 배치됩니다(그림 8). 이 구멍을 통해 관심 우물의 신호가 감지기에 도달하고 주변에서 들어오는 모든 빛은 물리적으로 차단됩니다. 비엠지랩텍의 멀티 모드 마이크로 플레이트 판독기 PHERAstar®FSX와 VANTAstar® 및 CLARIOstar® Plus에는 향상된 발광 감지를 위한 조리개가 함께제공됩니다.
 b) 수학적 크로스토크 감소
b) 수학적 크로스토크 감소흰색 마이크로플레이트에서도 우물의 플라스틱 벽을 통해 빛이 비칠 수 있습니다. 마이크로 플레이트의 유형은 플레이트의 벽을 통해 비추는 크로스토크에 큰 영향을 미칩니다. 일반적으로 고밀도 플레이트(예: 1536 웰)는 벽이 더 얇기 때문에 저밀도 플레이트보다 벽을 통한 빛 누출이 더 많이 나타납니다. 두 번째 측면은 우물 형상입니다. 정사각형 우물은 인접한 우물이 벽을 공유하기 때문에 벽 통과 누화가 더 높습니다. 둥근 우물은 벽을 공유하지 않으므로 벽을 통한 누화가 더 낮습니다. 또한 플레이트의 색상은 마이크로 플레이트 벽을 통한 크로스토크에 영향을 미치며, 플레이트가 어두울수록 크로스토크가 낮아집니다. 회색 플레이트는 크로스토크 감소와 신호 반사 사이의 절충점을 제공합니다.
플레이트를 추가로 최적화할 수 없는 경우, 수집된 데이터에 수학적 크로스토크 감소를 적용할 수 있습니다. 이를 위해 인접한 우물로의 신호 누출을 결정하고 알고리즘이 데이터를 보정합니다. 자동 결정 및 크로스토크 보정 기능은 비엠지랩텍의 플레이트 리더기PHERAstar®FSX,VANTAstar® 및 CLARIOstar®Plus에서 찾아볼 수 있습니다.
흰색 플레이트는 빛에 노출된 후 플레이트 자체에서 빛을 발산하는 고유한 인광을 가지고 있습니다. 이 신호는 데이터를 변경하여 공백을 늘리고 분석 창을 줄일 수 있습니다. 따라서 어둠 속에서 플레이트를 준비하거나 측정하기 약 15분 전에 플레이트를 어둠 속에 두는 것이 좋습니다.
필터는 주로 BRET 측정에 필요합니다. 발광은 종종 낮은 신호 출력을 나타내므로 80~100nm의 넓은 대역폭을 가진 필터를 사용하는 것이 좋습니다. 대역폭이 넓을수록 감지기에 더 많은 빛이 통과하여 측정 감도가 높아집니다.
리포터 분석은 리포터 분자의 유전 정보와 결합된 유전자 조절 서열을 사용하여 유전자 발현의 변화 또는 조절 영역 자체의 변형을 연구합니다. 리포터 유전자의 유전 정보를 세포에 도입해야 합니다. 리포터 유전자가 활성화되면 효소가 전사되고 번역됩니다. 기질이 있으면 변환되고 빛이 생성되며, 그 방출은 조절 서열의 활동을 보고합니다.
이중 루시퍼라제 리포터분석(DLR™)은 시스템에 두 번째 리포터를 추가합니다. 관심 있는 조절 서열에 결합된 리포터 옆에 '하우스키핑' 프로모터로 제어되는 두 번째 루시퍼라제가 내부 제어 역할을 합니다. CLARIOstar 또는 VANTAstar와 발광 스캔 옵션을 사용하면 일치하는 루시퍼라제를 식별하고 단일 멀티플렉싱 루시퍼라제 분석에서 최대 6개의 루시퍼라제를 결합할 수 있습니다.
가장 널리 사용되는 생존력 분석은 반딧불이 효소를 기반으로 합니다. 이 효소의 활성은 ATP 수치가 상승함에 따라 증가하며 발광량도 증가합니다. 생존 가능한 세포는 세포 용해 후 반응에 연료를 공급하는 ATP를 생성합니다. 따라서 방출은 세포 수 및 생존율과 상관관계가 있습니다. ATP 기반 엔드포인트 생존력 분석 외에도 발광 분석은 실시간으로 세포 생존력을 측정할 수 있습니다. 이를 위해 세포 배양에 프로-기질과 반딧불 효소를 첨가합니다. 프로-기질은 생존 가능한 세포에 의해서만 환원된 다음 발광 반응으로 처리됩니다. 이러한 방식으로 발광은 생존력 변화를 실시간으로 보고합니다. 이러한 분석에 대한 자세한 내용은 과학 강연 "적은 노력으로 더 나은 데이터를 제공하는 실시간 세포 건강 분석"에서 확인할 수 있습니다. 세포 생존력 분석은 신약 개발을 위한 표적 단백질 분해에서 단백질 분해 키메라(PROTAC) 및 분자 접착제를 사용한 작업과도 관련이 있습니다. 여기에는 알려진 디그론과 리가제 간의 특정 상호 작용으로 인해 발생하는 표적 단백질 분해와 관련된 연구가 포함됩니다.

세포 대사는 다양한 분자 전환 단계를 포함합니다. 대사 세포 경로를 감지하는 데 사용할 수 있는 많은 분석법은 발광을 기반으로 합니다. 기본 대사는 포도당과 같은 주요 영양소의 사용에 중점을 둡니다. 예를 들어 글루코스 글로 분석법으로 포도당 소비량을 추적할 수 있습니다. 포도당 소비량을 간접적으로 측정하기 위해 포도당의 분해 산물인 젖산염도 젖산염 글로 분석법으로 검출할 수 있습니다. 두 분석의 성능은 애플리케이션 노트: 포도당 분석과 젖산염 분석을 통해 세포 기반 분석에서 세포 포도당 대사를 정밀하게 모니터링할 수 있습니다. 앱노트: Promega ROS-Glo™ 분석을 사용한 세포 기반 형식의 ROS 검출에서는 과도하게 생성된 활성 산소 종의 검출을 위한 발광 기반 분석의 사용법을 보여줍니다.
수용체는 일반적인 약물 표적이며 리간드는 가능한 치료제입니다. 리간드와 수용체의 결합은 BRET 원리를 사용하여 세포 기반 분석에서 연구할 수 있습니다. 루시퍼라제는 수용체의 세포 외 부분에서 발현되고 리간드는 적절한 수용체 형광물질로 표지됩니다. 리간드가 수용체와 결합하면 공여체와 수용체가 에너지를 전달할 수 있을 만큼 가까워지고 BRET 비율이 증가합니다. 이 방법을 사용하면 표지되지 않은 화합물의 수용체 결합을 연구할 수도 있습니다. 이들은 형광 발색체로 표지된 알려진 리간드와의 결합을 위해 경쟁할 수 있습니다. 이러한 경쟁적 설정에서 BRET 비율이 감소하면 표지되지 않은 화합물이 수용체 분자를 대체하여 전달이 손실됩니다(그림 9).
이러한 분석이 수용체 약리학 연구에 어떻게 도움이 되는지는 과학 강연 "수용체 약리학의 실시간 프로파일링"에서 설명합니다.

BRET의 원리는 두 단백질의 상호작용을 연구하는 데에도 사용됩니다. 이를 위해 상호 작용하는 단백질 중 하나는 루시퍼라제에, 다른 하나는 수용체 형광체에 결합합니다. 두 단백질이 상호 작용하면 에너지 전달이 일어나 형광체가 방출되고 BRET 비율이 증가합니다. 이 방법은 예를 들어 G-단백질 해리 및 β-아레스틴 모집을 연구하는 데 사용할 수 있습니다. 발광을 사용하여 상호작용을 연구하는 또 다른 방법은 애플리케이션 노트: 내인성 HiBiT CETSA 테스트 시스템으로 단백질 리간드 결합 측정에 설명된 HiBiT CETSA입니다. 이 접근법은 관심 있는 표적 단백질(POI)에 융합된 단편화된 HiBiT 나노루시퍼라제를 활용하며 표적 단백질 분해에서 단백질 분해 T아르제팅 키메라(PROTAC) 및 분자 글루를 스크리닝하는 데 사용할 수 있습니다. 이러한 유형의 접근 방식은 알려진 디그론과 리가제 간의 특정 상호작용으로 인해 발생하는 표적 단백질 분해 연구와도 관련이 있습니다. 생리적 조건에서 단편화된 루시퍼라제는 발광 판독이 가능한 기능성 효소를 형성하기 위해 완성될 수 있지만, 열을 가하면 POI의 변성으로 인해 이러한 효과를 방지할 수 있습니다. 리간드의 결합은 POI의 열 안정성을 증가시켜 녹는점의 측정 가능한 변화로 이어집니다.
단백질과 단백질의 상호 작용 외에도 BRET 원리는 바이오 센서로 작동하는 생체 분자의 검출에도 사용될 수 있습니다. 이 예에서는 합성 카나비노이드 수용체 작용제에 의한 G 단백질의 차등 활성화를 CAMYEL BRET 바이오센서를 활용하여 연구했습니다.
발광 마이크로플레이트 분석은 다른 메커니즘에 기반한 분석보다 더 민감한 경우가 많습니다. 예를 들어, 발광 ELISA와 생존력 분석은 각각 비색 및 흡광도 기반 분석보다 더 민감합니다. 또한 다양한 생물학적 질문에 대한 솔루션을 제공합니다. 민감한 특성으로 인해 처리량이 많은 애플리케이션에서 소량으로 많이 사용됩니다. 검출을 위해서는 방법 자체만큼이나 민감한 기기가 필요합니다. 추가 및 측정 원리에 기반한 균질한 분석이 가능하기 때문에 쉽고 빠르게 처리할 수 있다는 점이 non-HTS에서 발광을 사용할 때의 장점입니다. 또한 다양한 실시간 발광 분석을 통해 세포 프로세스가 발생하는 대로 정량화할 수 있습니다.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series