
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Aumente a sensibilidade do ensaio com fluorescência resolvida no tempo, reduzindo o ruído de fundo para imunoensaios precisos e estudos de interação.
Fluorescência é a emissão de luz por uma molécula após a excitação por luz em um comprimento de onda menor do que o emitido.
A detecção de fluorescência pode ser dividida principalmente em dois tipos de medições: fluorescência de estado estável e fluorescência resolvida no tempo. A principal diferença entre esses dois métodos baseia-se na natureza e nas propriedades das moléculas fluorescentes (fluoróforos) usadas e no consequente tempo de detecção.
O estado estacionário é o modo de detecção de fluorescência mais difundido e é comumente chamado de "intensidade de fluorescência". Os fluoróforos padrão (por exemplo, fluoresceína, rodamina etc.) emitem luz em um comprimento de onda específico em nanossegundos após a excitação. Esse intervalo de tempo muito curto entre a excitação e a emissão permite a detecção quase concomitante do sinal de emissão fluorescente com a excitação da amostra.
O segundo tipo, a fluorescência resolvida no tempo (TRF), é monitorada como uma função do tempo após a excitação. Em contraste com a intensidade de fluorescência de estado estável, a fluorescência resolvida no tempo baseia-se na detecção de decaimentos de intensidade e/ou na detecção retardada do sinal de emissão após a excitação. Nas medições de fluorescência com resolução de tempo, o pulso de luz de excitação é mais curto do que o tempo de decaimento do sinal fluorescente. A detecção de fluorescência com resolução de tempo só pode ser obtida quando o sinal de emissão do fluoróforo é prolongado até a faixa de micro ou até milissegundos, e não de curta duração em nanossegundos, como ocorre com os rótulos comuns (fig. 1).
Os lantanídeos (Ln) são um grupo de elementos químicos metálicos exclusivamente fluorescentes, geralmente conhecidos coletivamente como "elementos de terras raras". Os lantanídeos têm coeficientes de absorção (excitação) muito baixos e taxas de emissão lentas. Isso resulta em tempos prolongados de decaimento da fluorescência entre 0,5 e 3 milissegundos (vida útil longa). Todos os elementos de lantanídeo formam cátions trivalentes (Ln3+) e apresentam emissão em uma solução aquosa. Além disso, seus picos de emissão são muito nítidos e estreitos com um grande deslocamento de Stokes[1].
Os lantanídeos possuem propriedades favoráveis como sondas bioquímicas. Originalmente, eles foram empregados em sistemas biológicos como sondas luminescentes para o cálcio. De fato, foi demonstrado que a luminescência dos lantanídeos é um sensor sensível para locais de ligação de Ca2+ em proteínas[2].
Seu prolongado decaimento de fluorescência os torna fluoróforos ideais para aplicações de fluorescência resolvida no tempo. Quatro deles, európio, térbio, samário e disprósio, foram amplamente utilizados nas ciências da vida, especialmente em imunoensaios de fluorescência com resolução de tempo, sendo o európio e o térbio os mais usados (fig. 2).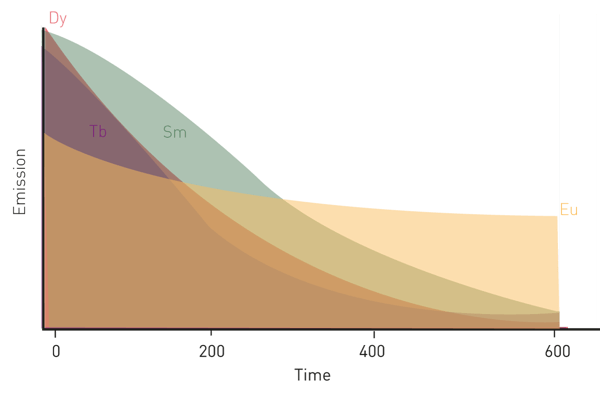
Os íons de európio (Eu3+), em particular, são usados com frequência como rótulos para detecção de fluorescência com resolução de tempo emensaios imunológicos. Além da longa emissão de fluorescência, o európio exibe um grande deslocamento de Stokes (290 nm) sem sobreposição entre o espectro de excitação e o de emissão e, com apenas 10 nm de largura de banda, um espectro de emissão muito nítido em 615 nm (fig. 3).
Como a emissão dos lantanídeos costuma ser muito fraca para aplicações de fluorescência com resolução de tempo, eles geralmente não são excitados diretamente, mas costumam ser incorporados em uma espécie de "gaiola" coletora de luz. Essa gaiola, geralmente um quelato ou um criptato, permite a coleta de energia e a transferência de energia para os íons lantanídeos, resultando em intensidades de emissão mais altas (fig. 4). Vale a pena mencionar que o espectro de excitação do complexo gaiola-lantanídeo reflete o espectro de absorção da "gaiola" e não do próprio lantanídeo[4].
Além de um sinal de emissão mais alto, a quelação possibilita a conjugação de íons lantanídeos a componentes biológicos (por exemplo, anticorpos, receptores, ligantes etc.), um requisito obrigatório para várias aplicações de fluorescência com resolução de tempo.
Semelhante à detecção de intensidade de fluorescência, a configuração para medições de fluorescência com resolução de tempo consiste em uma fonte de luz, um dispositivo óptico para seleção de comprimento de onda e um detector de tubo fotomultiplicador (PMT).
Como o complexo lantanídeo-quelato/criptato é normalmente excitado a 337 nm, uma lâmpada de flash de xenônio ou um laser específico é usado como fonte de luz para a detecção de fluorescência resolvida no tempo.Os leitores de placas multimodo são equipados com uma lâmpada de flash de xenônio de banda larga, pois oferecem mais flexibilidade para vários métodos de detecção. Os leitores de última geração podem oferecer, além disso, um laser opcional de excitação de fluorescência resolvida no tempo. O laser concentra mais energia nos comprimentos de onda de excitação específicos dos lantanídeos e, possivelmente, leva a melhores resultados com melhor discriminação entre sinais baixos e altos. Entretanto, dada a excitação acentuada em torno de 337 nm, essa é apenas uma fonte de luz de propósito único que não pode ser usada como fonte de excitação para outros métodos de detecção, exceto a fluorescência resolvida no tempo.
Com relação à seleção do comprimento de onda, os leitores de placas baseados em filtros e monocromadores podem ser empregados para a detecção de ensaios de fluorescência com resolução de tempo. Como os leitores baseados em filtros geralmente são mais sensíveis do que os monocromadores devido à maior transmissão de luz, eles são recomendados para ensaios de TRF com um rendimento limitado de fótons. Normalmente, os ensaios de transferência de energia de fluorescência com resolução temporal são particularmente desafiadores para os leitores baseados em monocromadores.
Os tubos fotomultiplicadores (PMTs) são usados como detectores. Devido às longas propriedades de emissão dos lantanídeos, na fluorescência com resolução de tempo, o detector PMT é ligado após a ocorrência da excitação. Isso permite que o sinal autofluorescente de curta duração desapareça. A intensidade do sinal de emissão é então integrada como uma função do tempo para uma janela de tempo específica. Esses dois parâmetros são chamados de "início da integração" e "tempo de integração" e geralmente estão na faixa de microssegundos (fig. 5).
Os leitores de microplacas de última geração também podem ser equipados com os chamados PMTs de contagem de fótons para fluorescência resolvida no tempo. Embora normalmente os leitores de microplacas simplesmente forneçam um valor de integração para a área sob a curva durante o tempo de integração, a fluorescência resolvida no tempo - detecção de contagem de fótons dedicada - monitora toda a curva de decaimento do lantanídeo.
No leitor PHERAstar FSX, a detecção de contagem de fótons permite a medição e a exibição da curva de decaimento da emissão com uma resolução de tempo de 2 microssegundos. Esse recurso exclusivo, denominado Monitoramento da curva de decaimento, simplifica o desenvolvimento de ensaios de fluorescência com resolução de tempo, ajudando a otimizar os parâmetros de tempo e, assim, melhorando a detecção do sinal e reduzindo o ruído de fundo.
Os imunoensaios baseados em fluorescência com resolução temporal são usados para quantificar moléculas específicas, como proteínas ou citocinas. Eles dependem do reconhecimento e da ligação do alvo por anticorpos específicos que foram marcados com um fluoróforo. A análise e a quantificação do sinal fluorescente fornecem indiretamente informações sobre as moléculas-alvo. Os imunoensaios são quantitativos, altamente sensíveis e oferecem a possibilidade de detecção de vários parâmetros (multiplexação).
Semelhante aos ensaios ELISA clássicos, os imunoensaios de fluorescência com resolução de tempo geralmente usam um anticorpo de captura ligado ao fundo do poço da microplaca. À medida que as amostras são incubadas nesses poços, o anticorpo captura a molécula alvo na placa. Após a remoção da amostra não ligada por meio da lavagem da placa, é adicionado um segundo anticorpo ligado covalentemente a um quelato de lantanídeo, mais comumente o európio. Isso liga a molécula alvo, enquanto o segundo anticorpo não ligado é lavado. A quantidade de anticorpo marcado com lantanídeo é proporcional à concentração da molécula alvo na amostra. Os imunoensaios de fluorescência com resolução de tempo podem ser realizados como ensaios diretos ou competitivos.
É necessária uma etapa de aprimoramento dissociativo para liberar as moléculas de európio de sua "gaiola" no anticorpo por três motivos: primeiro, os lantanídeos têm baixa absorção de luz; segundo, eles raramente são excitados diretamente; e terceiro, os quelatos de lantanídeos são pouco fluorescentes quando conjugados a componentes biológicos (anticorpos, nesse caso). A dissociação é promovida pela adição de uma solução específica, comumente chamada de "solução de aprimoramento". Além de dissociar o lantanídeo, a solução promove a formação de uma nova "gaiola" de quelato que incorpora o cromóforo necessário para a excitação do lantanídeo. O quelante-cromóforo na solução intensificadora é usado para absorver e transferir a luz de excitação para o lantanídeo, aumentando significativamente a intensidade do sinal de emissão (fig. 6).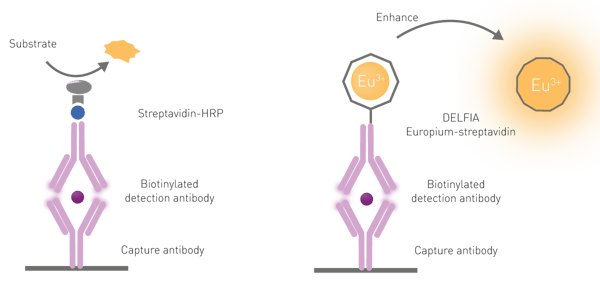
As amostras são excitadas por um pulso de luz em um comprimento de onda específico, geralmente 337 nm. A detecção é limitada pelo tempo de decaimento do sinal de autofluorescência. Isso significa que a detecção de fluorescência com resolução de tempo começa somente após a exaustão do sinal de autofluorescência de curta duração (microssegundos). O sinal de emissão detectado é integrado em uma janela de tempo específica e os dados são medidos como intensidade integrada, não como decaimento do tempo. Como a quantidade de analito é proporcional ao sinal de emissão resolvido no tempo, ela pode ser facilmente quantificada com o uso de uma curva padrão.
Um dos imunoensaios de fluorescência com resolução de tempo mais comumente usados é o DELFIA®.
O DELFIA (Dissociation-Enhanced Lanthanide Fluorescent Immunoassay) é um ensaio heterogêneo baseado em lavagem de fluorescência resolvida no tempo, desenvolvido com base em um princípio e fluxo de trabalho semelhantes aos ELISAs. Diz-se que ele supera as limitações típicas dos ensaios ELISA, fornecendo uma faixa dinâmica mais ampla e sinais estáveis que podem ser medidos até meses após a execução do ensaio. Para a detecção DELFIA, os leitores de placas devem ser equipados com detecção de fluorescência resolvida no tempo com excitação a 337 nm e emissão a 615 nm.
Nos ensaios DELFIA, os anticorpos de captura são ligados à microplaca. Após a adição da amostra e uma série de etapas de lavagem para eliminar a amostra não ligada, é adicionado um anticorpo de detecção marcado com európio. Por fim, uma solução de aprimoramento é adicionada após uma série final de lavagens. Como mencionado acima, os ensaios DELFIA exigem uma etapa de aprimoramento dissociativo para produzir um sinal fluorescente. Essa dissociação promove a formação de um novo quelato altamente fluorescente em uma solução micelar estável. Um exemplo de um imunoensaio DELFIA é mostrado na nota de aplicação "Imunoensaio de Fluorescência Resolvida no Tempo (TRF) em formato de 384 poços usando um kit de par de anticorpos combinados e o PHERAstar FSX".
Embora robustos e muito sensíveis, os ensaios DELFIA não são adequados para triagem de alto rendimento, pois o procedimento envolve etapas de ligação, incubação e lavagem.
Os exossomos são vesículas extracelulares de origem endossômica, contendo ácidos nucleicos, proteínas e lipídios. Eles facilitam a comunicação intercelular entre diferentes tipos de células em um organismo. Os kits de detecção de exossomos por fluorescência resolvida no tempo TRIFic™ detectam a presença de exossomos com base na expressão de proteínas de membrana específicas.
Sondas fluorescentes específicas sensíveis ao oxigênio e ao pH estão disponíveis para a análise de parâmetros metabólicos celulares no modo de fluorescência resolvida no tempo. Em notas de aplicação específicas, mostramos como o consumo de oxigênio intracelular e extracelular , bem comoa atividade glicolítica, podem ser determinados em tempo real em células vivas.
Provavelmente, a outra aplicação mais popular da fluorescência resolvida no tempo pode ser encontrada no TR-FRET ( transferência de energia de fluorescência resolvida no tempo). Seu principal uso é encontrado em aplicações de triagem de medicamentos ede alto rendimento, pois os ensaios de transferência de energia de fluorescência resolvida no tempo são robustos e fáceis de automatizar e miniaturizar. Sua principal aplicação são os estudos de interação proteína-proteína ou ligante-receptor.
A autofluorescência é emitida por todas as amostras biológicas e geralmente é um fator limitante para a sensibilidade do ensaio. Como ela decai em nanossegundos, as medições de fluorescência com resolução de tempo (time-gated) na faixa de micro ou milissegundos permitem detectar o sinal de emissão dos lantanídeos após a exaustão do sinal de autofluorescência. O ruído fluorescente de "vida curta" (sinais de fundo e luz de excitação dispersa) é eliminado e os sinais de fluorescência resolvidos no tempo (de vida longa) podem ser medidos com sensibilidade muito alta, sendo que o único sinal de fundo é o rótulo ligado de forma não específica. Isso reduz o ruído de fundo e aumenta a sensibilidade quando comparado à detecção de intensidade de fluorescência em estado estável.
A diferença entre os máximos (picos) de comprimento de onda de excitação e emissão é definida como deslocamento de Stokes. Para muitos fluoróforos de estado estável disponíveis comercialmente, esse deslocamento é relativamente estreito e resulta em extinção automática do sinal devido à sobreposição entre os espectros de absorção e emissão. Por outro lado, os lantanídeos têm grandes deslocamentos de Stokes, o que aumenta muito a relação sinal/plano de fundo (S/B) na detecção de fluorescência com resolução de tempo.
Os lantanídeos têm um alto rendimento quântico com uma intensidade de fluorescência maior do que os fluoróforos "regulares". Isso melhora significativamente a sensibilidade do ensaio na fluorescência com resolução de tempo. É importante observar que o alto rendimento quântico torna os lantanídeos perfeitamente adequados como doadores, mas inadequados como aceitadores.
Se os imunoensaios de fluorescência com resolução de tempo forem interrompidos antes da etapa de dissociação/aumento e armazenados adequadamente, os ensaios são estáveis por até 10 anos, de acordo com os fabricantes. A única etapa necessária para reanimá-los é a adição da solução de aprimoramento.
Conforme discutido acima, os quelatos geralmente incorporam lantanídeos em "gaiolas" que têm a função de estabilizar, ligar o fluoróforo a uma molécula ou aprimorar suas propriedades fluorescentes. Na detecção de fluorescência com resolução de tempo, essa última etapa é necessária para aumentar as intensidades de emissão que seriam bastante fracas se os lantanídeos estivessem em seu estado "natural". No entanto, a troca entre esses diferentes tipos de gaiolas apresenta uma limitação significativa, pois são necessárias várias etapas intermediárias, como lavagem ou adição de soluções. Normalmente, esse não é o caso dos ensaios baseados em intensidade de fluorescência.
Embora mais sensível e eficiente, a detecção de fluorescência com resolução de tempo exige um gasto maior com reagentes e instrumentação, em comparação com os métodos de intensidade de fluorescência.
Os ensaios de fluorescência com resolução de tempo geralmente exigem a detecção a partir da parte superior do poço e, normalmente, são executados em placas brancas. Como a detecção com atraso de tempo elimina a autofluorescência e reduz o fundo, as placas brancas são vantajosas. Elas refletem e aumentam a emissão de luz, fornecendo sinais mais fortes. As placas pretas são sugeridas caso um sinal forte possa saturar o detector.
Para ensaios baseados em células de fluorescência com resolução de tempo, recomenda-se a detecção a partir do fundo de uma placa com paredes brancas/pretas e fundo transparente. Entretanto, como nem todos os fundos claros são transparentes aos raios UV, o plástico pode absorver a luz a 340 nm e, portanto, reduzir significativamente a luz de excitação (normalmente a 337 nm). Antes de executar seu ensaio de fluorescência com resolução de tempo, é recomendável verificar as especificações da sua microplaca e usar placas com fundo transparente aos raios UV. Para obter mais detalhes, leia nossa postagem no blog "A microplaca: utilidade na prática".
Conforme discutido anteriormente, a detecção resolvida no tempo elimina a autofluorescência. Entretanto, as etapas de lavagem após a incubação com reagentes marcados com lantanídeos e antes da adição da solução de realce são bastante críticas e podem afetar a qualidade do ensaio. Essas etapas precisam ser muito eficientes para remover todos os reagentes marcados não ligados. Se esse não for o caso, o ensaio produzirá um sinal de fundo alto causado pela presença de íons lantanídeos não específicos não ligados.
Para os ensaios DELFIA, os tampões à base de tris-HCl devem ser preferidos aos à base de fosfato. Por um lado, as altas concentrações de fosfato podem dissociar o európio de seu quelato durante longos períodos de incubação. Por outro lado, o sinal máximo é geralmente menor com o tampão à base de fosfato quando comparado ao à base de tris-HCl.
O pH baixo pode potencialmente liberar o íon lantanídeo de seu quelato. Isso pode afetar negativamente a integridade do corante e aumentar a ligação não específica e o fundo na detecção de fluorescência com resolução de tempo. Além disso, tome cuidado com a presença de EDTA em seus reagentes, pois ele pode inativar os quelatos de lantanídeos.
Como os lantanídeos não têm emissão de luz polarizada, eles não podem ser usados para medições de anisotropia/polarização de fluorescência[5].
DELFIA é uma marca registrada da Perkin Elmer, Inc.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series