
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Utilize a polarização de fluorescência para estudos de ligação, aplicações de triagem e análise de interação molecular.
A polarização de fluorescência (FP) é um método de detecção baseado em fluorescência amplamente utilizado para monitorar interações moleculares em solução. Ao contrário da intensidade de fluorescência, quese concentra na quantificação da intensidade de emissão em um comprimento de onda específico e negligencia sua polarização, a polarização de fluorescência analisa especificamente como saída a intensidade de emissão de diferentes planos de polarização.
A FP é normalmente usada para avaliar as interações biomoleculares, como a ligação proteína-proteína e proteína-DNA, bem como a atividade enzimática. Ela foi adotada na pesquisa básica e na triagem de alto rendimento.
Inicialmente, a polarização por fluorescência foi usada principalmente no campo do diagnóstico. Um imunoensaio de FP foi descrito pela primeira vez na década de 1960. Na pesquisa de ciências biológicas, as aplicações foram inicialmente limitadas devido à falta de instrumentos sensíveis. Atualmente, o FP está se tornando muito popular na pesquisa biológica. Isso se deve principalmente ao aumento do desempenho e da sensibilidade dos modernos leitores de microplacas, quepodem fornecer resultados robustos com variabilidade mínima e janelas de ensaio maiores.
A luz é uma onda eletromagnética cujo campo elétrico oscila perpendicularmente à direção de propagação. A luz não polarizada (não polarizada) é definida como aquela em que a direção da oscilação de seu campo elétrico flutua aleatoriamente no tempo. Fontes de luz comuns, como a luz solar e as lâmpadas incandescentes e halógenas clássicas, produzem luz não polarizada.
Se a direção do campo elétrico for restrita a um plano por um filtro específico, todas as ondas de luz selecionadas oscilarão em uma única direção, produzindo luz plana ou polarizada. A fonte mais comum de luz polarizada são os lasers. A luz não polarizada pode ser vista como um conjunto de ondas de luz polarizadas em diferentes planos, sem nenhum estado predominante de polarização (fig. 1).
Dependendo da orientação de seu campo elétrico, a luz polarizada é classificada em linear, circular e elíptica. A polarização linear, cujo campo elétrico é limitado a um único plano ao longo da direção de propagação, é usada predominantemente em aplicações de ciências biológicas e é o foco deste artigo. Para a reflexão e transmissão da luz, os dois estados de polarização linear mais relevantes são paralelo e perpendicular (em relação ao plano de incidência).
A detecção de polarização de fluorescência baseia-se na teoria geral da detecção de fluorescência em estado estável, que pode ser encontrada na página de intensidade de fluorescência. Além disso, sua detecção se baseia no fato de que o grau de polarização de um fluoróforo é inversamente relacionado à sua taxa de queda e na observação de que a luz emitida por um fluoróforo pode ter diferentes intensidades em diferentes planos de polarização, normalmente perpendiculares e paralelos ao plano de excitação.
Quando a luz polarizada no plano excita uma molécula fluorescente pequena (normalmente <1,5 kDa) e não ligada (o marcador), ela emite principalmente luz não polarizada. Isso é causado pelo fato de que uma molécula pequena e livre gira rapidamente em solução durante o tempo entre a excitação e a emissão e, consequentemente, emite luz em diferentes planos de polarização (não polarizada).
Por outro lado, se a molécula fluorescente pequena estiver ligada a uma molécula maior (normalmente >10 kDa), seu volume molecular aumentado desacelera sua rotação e resulta na emissão de luz predominantemente polarizada no mesmo plano da fonte de excitação (fig. 2).
A polarização da fluorescência é, portanto, a medida da quantidade de rotação molecular que ocorre no tempo entre a excitação e a emissão do marcador. Ela é calculada pela equação a seguir:
P = (F|| - F⊥)/(F|| + F⊥)
Quantitativamente, é definida como a diferença entre a intensidade de emissão de fluorescência paralela (F||) e perpendicular (F⊥) ao plano de luz de excitação, dividida pela intensidade total de emissão de fluorescência.1
O valor P é um número sem dimensão, pois é uma proporção de intensidades de luz. Geralmente é expresso em milipolarização (mP), em que 1 P = 1000 mP. Embora P tenha valores que variam de -330 a 500 mP, esses limites teóricos raramente são alcançados. Em aplicações bioanalíticas, os dados típicos variam de 10 a 300 mP (por exemplo, fig. 3).
O termo anisotropia foi introduzido em 1960 e é usado com frequência no contexto da emissão polarizada. A anisotropia (designada como A ou r) é a razão das intensidades de emissão na equação abaixo:
r = (F|| - F⊥)/(F|| + 2 F⊥)
F|| indica a intensidade após a excitação polarizada verticalmente e a polarização vertical na luz de emissão. F⊥ indica a intensidade ao usar um polarizador vertical na excitação e um polarizador horizontal na emissão. 2
A polarização e a anisotropia da fluorescência estão matematicamente relacionadas e são usadas de forma intercambiável. Ambas são derivadas das intensidades de emissão de luz polarizada e não polarizada e representam uma média dos estados ligado/não ligado de uma molécula fluorescente. Para a maioria das aplicações, o conteúdo de informações de suas funções é idêntico, pois a anisotropia não fornece nenhuma informação adicional.3
Normalmente, a escolha de um termo ou de outro depende de considerações práticas e do hábito. A polarização da fluorescência é usada com mais frequência para descrever toda a tecnologia e em química clínica, enquanto a anisotropia é mais comum em biofísica e bioquímica.
A polarização da fluorescência pode ser detectada em um leitor de microplacas e depende do mesmo procedimento e configuração que a intensidade da fluorescência. No entanto, há algumas diferenças relacionadas principalmente à seleção dos planos de polarização.
A amostra é excitada em um comprimento de onda específico por luz polarizada vertical (paralela). A fonte de luz de excitação é normalmente uma lâmpada de xenônio ou halogênio. Sua luz branca é filtrada espectralmente usando um filtro ou um monocromador. O plano de polarização é selecionado por um filtro específico chamado polarizador.
O vetor do campo elétrico da luz natural pode assumir qualquer direção de oscilação em relação à direção de propagação. Os polarizadores são elementos ópticos, geralmente filmes finos, que podem isolar uma direção do vetor elétrico. O polarizador de excitação é posicionado entre a fonte de excitação e a amostra. A orientação relativa do plano vertical transmite luz paralela para a amostra e bloqueia a luz polarizada perpendicular.
A luz emitida por uma amostra é filtrada espectralmente por um filtro ou monocromador para remover comprimentos de onda indesejados. Além disso, a luz emitida precisa ser separada em ondas paralelas ou perpendiculares, dependendo de sua orientação em relação ao plano da luz de excitação polarizada. Isso é possível por meio de polarizadores de emissão posicionados no caminho da luz entre a amostra e o detector, que são normalmente do mesmo tipo que o polarizador de excitação. Por fim, a intensidade dos dois planos polarizados é quantificada por um detector, normalmente um tubo fotomultiplicador (PMT).
Os dois planos são detectados separadamente. A abordagem mais simples é detectar os planos paralelo e perpendicular com duas medições sequenciais. Depois que a intensidade da polarização paralela é detectada na primeira medição, o polarizador de emissão girado em 90° é usado para detectar o plano horizontal (perpendicular) (fig. 4).
Os leitores de placas de polarização de fluorescência de alta qualidade, como o PHERAstarFSX, podemadquirir os dois planos de polarização simultaneamente, graças àtecnologia de detecção de Emissão Dupla Simultânea. Essa abordagem economiza tempo e reduz a variabilidade gerada por duas medições sequenciais.
Em geral, os monocromadores não são recomendados para a detecção de FP devido à sua baixa transmissão intrínseca de luz e ao alto nível de fundo (luz difusa). Esses fatores contribuem para aumentar a variabilidade da amostra, afetando negativamente a janela e a robustez do ensaio.
Para a detecção na faixa de UV, os leitores devem ser equipados com uma lâmpada de xenônio. As lâmpadas de halogênio não são recomendadas devido à sua baixa emissão abaixo de 400 nm. Além disso, são necessários polarizadores UV específicos, pois os comuns têm uma transmissão ruim nos comprimentos de onda UV.
Níveis baixos de polarização (P) indicam que as moléculas fluorescentes não se ligam e se movem livremente na solução. Embora a faixa de medição em aplicações bioanalíticas de 10 a 300 mP possa parecer bastante restrita, medições muito precisas com desvios padrão de ± 0,5 mP podem ser obtidas com leitores de microplacas multimodo de alta qualidade, como o PHERAstar FSX ou o CLARIOstarPlus.
A escolha de um corante fluorescente em ensaios de FP é de fundamental importância. Seus espectros de excitação e emissão devem ser diferentes dos comprimentos de onda de outras moléculas presentes na solução para reduzir a autofluorescência e precisam ter um grande deslocamento de Stokes para reduzir a influência negativa da dispersão da luz. Os fluoróforos devem ser facilmente conjugados ao traçador, mas não devem perturbar seu movimento nem interferir na interação. Além disso, eles precisam ter um alto rendimento quântico (ou seja, alta intensidade) e ser quimicamente estáveis e fotoestáveis.4
Os fluoróforos mais comumente usados são o isotiocianato de fluoresceína (FITC) e corantes com espectros semelhantes. No entanto, recentemente, impulsionados pela melhoria no desempenho dos modernos leitores de microplacas, os corantes vermelhos, como o Cy3B e o Cy5, ganharam popularidade. Como seu baixo rendimento intrínseco de fótons não representa mais uma limitação devido às melhorias técnicas na detecção de sinais, seu uso pode ser vantajoso para reduzir os falsos negativos derivados da autofluorescência, que geralmente emitem na faixa verde e azul, e os falsos positivos causados por eventos de dispersão de luz.5
Entre as abordagens usadas para estudar eventos de ligação molecular, a FP é única. Como ela se baseia em uma única estratégia de marcação fluorescente, não são necessárias etapas adicionais de separação. Dessa forma, podem ser usados menos reagentes e, em geral, mais baratos, em comparação com os métodos convencionais. Além disso, como a integridade da amostra não é afetada, as amostras podem ser medidas repetidamente, desde que o pH, a temperatura e a viscosidade sejam constantes.
O FP permite o monitoramento direto da relação livre/ligado de um traçador em solução em tempo real, permitindo a análise de equilíbrio com concentrações muito baixas (normalmente até a faixa picomolar). Entretanto, devido à sua natureza em tempo real, os experimentos não se limitam ao equilíbrio, e a cinética de associação/dissociação pode ser facilmente analisada.
A FP é uma técnica homogênea com um protocolo simples de mistura e leitura que não exige a separação das espécies ligadas e livres a serem medidas. Os ensaios homogêneos fornecem uma quantificação mais precisa dos eventos de ligação, pois a reação de ligação não é perturbada por etapas adicionais. No entanto, é importante observar que outros ensaios homogêneos, como FRET, TR-FRET ou AlphaScreen®, exigemoutras reações de marcação além da marcação única do marcador.
Além disso, a natureza ratiométrica do FP elimina a influência negativa que a absorbância ou a extinção do composto pode ter na aquisição de dados e permite a miniaturização. Todos esses motivos levaram à adoção de ensaios de FP na triagem de alto rendimento.
Apesar de todas as suas vantagens, há algumas limitações nesse sistema de medição. A FP requer grandes alterações no volume molecular para a geração do sinal máximo e da janela do ensaio. Na melhor das hipóteses, um ensaio de ligação por polarização de fluorescência pode monitorar a interação entre uma molécula pequena e uma molécula grande e requer a marcação do menor parceiro de interação com um fluoróforo. Dessa forma, os traçadores geralmente são pequenas proteínas ou peptídeos, citocinas e compostos químicos. Isso geralmente garante a maior diferença possível no volume molecular após a ligação e, portanto, a maior janela de ensaio possível. O ensaio de ligação FP não é adequado para a observação da interação de duas proteínas grandes.
Além disso, a autofluorescência do composto e a dispersão da luz podem causar artefatos. Por isso, geralmente recomenda-se quantificar o fundo de fluorescência de um poço antes da adição do corante fluorescente e subtraí-lo do cálculo. Como a autofluorescência é normalmente menos pronunciada em comprimentos de onda mais altos, a adoção de corantes vermelhos, como os corantes BODIPY TMR ou Cy5, pode ser usada para minimizar o ruído de fundo.6, 7
O ensaio de ligação por FP pode ser empregado para analisar eventos de interação ou dissociação molecular em interações proteína-ligante oupeptídeo-proteína, interações proteína-DNA, bem como agregação de proteína pré-fibrilar. Além disso, ele também pode ser usado para identificar compostos interferentes e inibidores não específicos.
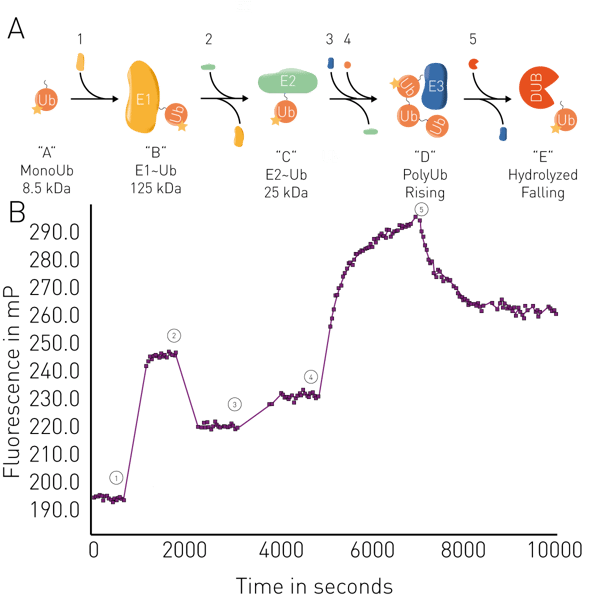
Outras aplicações incluem a análise da fluidez da membrana em lipossomos e membranas mitocondriais, e ensaios enzimáticos como proteólise, síntese de RNA, cinética de ligação e conjugação/desconjugação de ubiquitina em tempo real (fig. 5). As aplicações em tempo real para a ubiquitina podem ser usadas, por exemplo, na degradação de proteínas direcionadas para PROteolysis TArgeting Chimeras (PROTACs) ou colas moleculares, incluindo estudos de sua atividade de ligação com seus alvos e a cinética das interações. Os ensaios de ligação de FP também podem ser usados para analisar a degradação de proteínas direcionadas decorrente de interações específicas entre degrons e ligases conhecidos.
Nos anos 90, a FP foi adotada no ambiente de triagem de medicamentos para facilitar o processo de descoberta de medicamentos. Atualmente, ela é usada rotineiramente em instalações de triagem, devido ao seu formato homogêneo, rápido e quantitativo. Como a FP costuma ser linearmente proporcional à porcentagem de traçador ligado/livre, ela é frequentemente empregada para determinar os valoresde IC50 de candidatos a medicamentos.
Na descoberta de medicamentos, ele tem sido usado para estudar diferentes alvos, como GPCRs, quinases, fosfatases e proteases. Enquanto, nos estudos de interação, a FP geralmente detecta um aumento no volume molecular, nos ensaios de dissociação e degradação enzimática, a diminuição do volume molecular é normalmente usada como leitura.
As principais aplicações dos ensaios de polarização por fluorescência em HTS são a análise de interações moleculares diretas e reações enzimáticas. Aqui, leitores de microplacas rápidos e sensíveis permitem a triagem eficiente de pequenas moléculas para uma gama crescente de classes de alvos. Os exemplos incluem a triagem de inibidores do regulador de ubiquitinação e do alvo anticâncer CSN5, bem como a triagem de inibidores da H-Prostaglandina D Sintase.
A transferência de energia de ressonância de Förster (FRET) é um método comum para estudar eventos de interação. Normalmente, os dois possíveis parceiros de interação são marcados com dois fluoróforos diferentes (doador e aceitador). A FRET, no entanto, também pode ocorrer entre fluoróforos semelhantes (homoFRET). A FP pode ser aplicada à homoFRET, pois a transferência de energia causa aleatoriedade na polarização da emissão, produzindo um sinal despolarizado. O homoFRET-FP pode ser usado para estudar o acúmulo de proteínas ou eventos de dimerização em uma célula, conforme descrito na nota de aplicação "Monitoring of insulin granule packaging in live cells using homoFRET-FP detection" (monitoramento do empacotamento de grânulos de insulina em células vivas usando detecção homoFRET-FP) (fig. 6).
O imunoensaio de polarização por fluorescência (FPIA) foi o primeiro a ser aplicado em bioquímica. É um ensaio bioquímico competitivo usado para detectar antígenos ou anticorpos. Em um imunoensaio de polarização por fluorescência, um antígeno ligado a um fluoróforo é usado como marcador. Normalmente, esse antígeno e um segundo antígeno competem para se ligar a um anticorpo selecionado. A alta ligação entre o marcador e o anticorpo normalmente resulta em um sinal polarizado, ao passo que, se o antígeno não marcado for predominantemente ligado ao anticorpo, o marcador livre gerará luz não polarizada. Essa alteração é proporcional à quantidade de antígeno presente na amostra.8
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows