
PHERAstar FSX
Powerful and most sensitive HTS plate reader


As microplacas são fornecidas em diferentes cores, materiais, densidades de poços e geometrias; explore qual formato é mais adequado para suas aplicações.
As microplacas são equipamentos de laboratório que consistem em uma placa com várias cavidades (poços) usadas como pequenos tubos de amostra. Elas também são chamadas de placas de microtitulação ou multipoços e geralmente são fornecidas nos formatos de 6, 12, 24, 48, 96, 384 ou 1536 poços, sendo o layout de 96 poços o mais comumente usado. Dependendo do tamanho do poço, eles podem conter volumes de amostra de microlitros a mililitros.
As microplacas facilitam a preparação, o manuseio, o exame, o processamento e o gerenciamento de muitas amostras. Atualmente, elas são um padrão em pesquisas farmacêuticas e de ciências biológicas, bem como em diagnósticos clínicos e pesquisas analíticas. Os ensaios de imunoabsorção enzimática (ELISA) são uma das aplicações mais comumente usadas. No entanto, os usos são diversos e generalizados nas ciências biológicas, incluindo armazenamento, filtragem, separação e mistura de amostras, bem como detecção e quantificação de amostras.

As microplacas foram criadas em 1951 pelo microbiologista húngaro Dr. Gyula Takátsy (fig. 1), quando uma epidemia de gripe levou a uma escassez de equipamentos de laboratório. Takátsy precisava encontrar soluções de baixo custo para prosseguir com seus testes clínicos. Ele percebeu que os testes eram muito caros em grandes lotes e que um aumento significativo no rendimento poderia ser obtido colocando-se várias amostras uma ao lado da outra. Assim, ele criou a primeira microplaca colocando 8 fileiras de 12 poços (8*12 = 96) juntos à mão e ligando-os com um laço de arame. Essa solução permitiu que ele economizasse tempo ao pipetar.
Na década de 1960, sua invenção ganhou popularidade gradualmente e foi adotada como equipamento padrão em testes biomédicos por laboratórios de todo o mundo.
O uso generalizado foi ainda mais facilitado no final da década de 1980, quando uma versão moldada foi introduzida. Isso reduziu o preço por unidade e aumentou a capacidade de produção. Nos anos seguintes, as microplacas foram aprimoradas e diversas variantes foram desenvolvidas para atender às diferentes necessidades da comunidade científica.
Na década de 1990, a Society for Biomolecular Screening (SBS) iniciou um esforço para padronizar os recursos e as formas. Os recursos incluíam principalmente o número, a forma e a dimensão dos poços, além de propriedades como dimensões gerais e material. Em 2003, o American National Standards Institute (ANSI) propôs e publicou um conjunto de recursos padronizados, que incluía o diâmetro, a profundidade e o espaçamento dos poços, bem como as dimensões gerais (ou seja, 127,76 mm × 85,48 mm).1
A padronização levou a um uso mais amplo, beneficiando especialmente a automação laboratorial e a produção de instrumentos de laboratório. Consequentemente, a popularidade da microplaca cresceu ainda mais como um suporte eficaz para a descoberta de medicamentos e a pesquisa em ciências biológicas. Estima-se que cerca de 125.000.000 de unidades foram usadas somente em 2000.2
Em 2010, a SBS e a Association for Laboratory Automation (ALA) se fundiram para formar a Society for Laboratory Automation and Screening (SLAS). Desde então, os padrões de microplacas são chamados de ANSI/SLAS.
Além do número de poços, as microplacas são fornecidas em diferentes materiais e cores e incluem diferentes formatos de poços e capacidades de volume. Com tantas opções, às vezes é difícil escolher a melhor para um ensaio específico. Aqui, tentarei resumir os principais recursos, mantendo o foco principal nas aplicações espectrofotométricas.
Embora existam pequenas diferenças no tamanho e na posição dos poços para os diferentes tipos de microplacas de diferentes fabricantes, todas as placas de microtitulação têm as mesmas dimensões de área útil. Os poços são geralmente dispostos em uma matriz retangular e normalmente são fornecidos nos formatos de 6, 12, 24, 48, 96, 384 e 1536 poços (fig. 2). Um layout de 3456 poços também está disponível, mas não é usado com frequência. O volume de preenchimento de cada poço depende do layout. O layout mais usado é o formato de 96 poços (até 300 µL/poço). Layouts de densidade mais alta geralmente são empregados para fins de miniaturização. Além de comportar mais amostras, os formatos de 384 poços (até 100 µL/poço), 1536 poços (até 15 µL/poço) e até 3456 poços (até 5 µL/poço) reduzem os volumes de reagentes e, consequentemente, os custos (Tabela 1).
O volume de preenchimento de cada poço depende do layout. O layout mais usado é o formato de 96 poços (até 300 µL/poço). Layouts de densidade mais alta geralmente são empregados para fins de miniaturização. Além de comportar mais amostras, os formatos de 384 poços (até 100 µL/poço), 1536 poços (até 15 µL/poço) e até 3456 poços (até 5 µL/poço) reduzem os volumes de reagentes e, consequentemente, os custos (Tabela 1).
Como regra geral, um terço do volume máximo de preenchimento é o menor volume recomendado para que um poço tenha uma medição eficiente e realista. Portanto, não se deve ir abaixo de 100 µL para uma placa de microtitulação padrão de 96 poços.
As microplacas de 96 poços com meia área (até 170 µL/poço) são soluções intermediárias. Elas têm essencialmente o mesmo tamanho de poço que o layout de 384 poços, mas mantêm as dimensões externas e as posições dos poços de 96 poços. Dessa forma, os poços são menores e permitem uma redução de até 50% no volume da amostra. Esse formato é normalmente usado como uma alternativa ao de 384 poços quando são necessários volumes baixos, mas a automação e o rendimento não são necessários.
Um conceito semelhante é aplicado aos layouts de 384 poços em formato de volume baixo ou pequeno (às vezes também chamado de "base alta"). Essas placas têm o mesmo tamanho de poço que um layout de 1536 poços com as dimensões externas e as posições de poço de uma placa de 384 poços. Da mesma forma, os volumes de amostra podem ser reduzidos em mais de 50% quando comparados a um poço padrão de 384 poços. Além do volume, o formato do poço também é afetado: enquanto os layouts regulares de 384 poços têm poços quadrados, os de baixo volume têm poços redondos.
Tabela 1: Comparação das diferentes capacidades de volume de preenchimento de diferentes layouts.
| Número do poço | Volume recomendado |
| 6 | 2-5 mL |
| 12 | 2-4 mL |
| 24 | 0,5-3 mL |
| 48 | 0,5-1,5 ml |
| 96 | 100-300 µL |
| 96 meia área | 50-170 µL |
| 384 | 30-100 µL |
| 384 volume baixo/pequeno | 5-25 µL |
| 1536 | 5-25 µL |
| 3456 | 1-5 µL |
Em geral, os formatos de densidade mais alta (ou seja, 1536 e 3456 poços) não podem ser pipetados manualmente, sendo necessária uma máquina de pipetagem. A pipetagem manual ainda é possível em 384 poços, mas é tediosa e geralmente não é recomendada. Consequentemente, é preciso avaliar se os custos mais altos de manuseio associados ao trabalho com microplacas de 1536 ou 3456 poços são contrabalançados pela economia de custos obtida com a miniaturização. Esse é o caso típico das instalações de triagem de alto rendimento, mas não da maioria dos laboratórios de ciências biológicas.
As placas para ELISA normalmente vêm com 96 poços e consistem em doze tiras separadas de oito poços (fig. 3). Essa arquitetura simplifica o uso e o manuseio parcial.
As placas de microtitulação podem ser fabricadas com diferentes materiais. Os mais comumente usados são os polímeros policarbonato, poliestireno e ciclolefina. A escolha do polímero afeta a transmissão de luz, a autofluorescência, a absorção de água e a troca de gases e, consequentemente, influencia o uso, as aplicações e a qualidade do ensaio.
Normalmente, o material mais usado para material plástico de laboratório é o poliestireno. Sua transparência o torna ideal para detecção óptica, ensaios de absorção (como ELISA) e microscopia com modificações moderadas. Entretanto, o poliestireno não transmite luz UV (< 320 nm) e, portanto, é inadequado para a quantificação de RNA e DNA. Para essa finalidade, o copolímero de ciclolefina (COC) apresenta melhor transmissão de luz ultravioleta na faixa de 200 a 400 nm e baixa autofluorescência (fig. 4).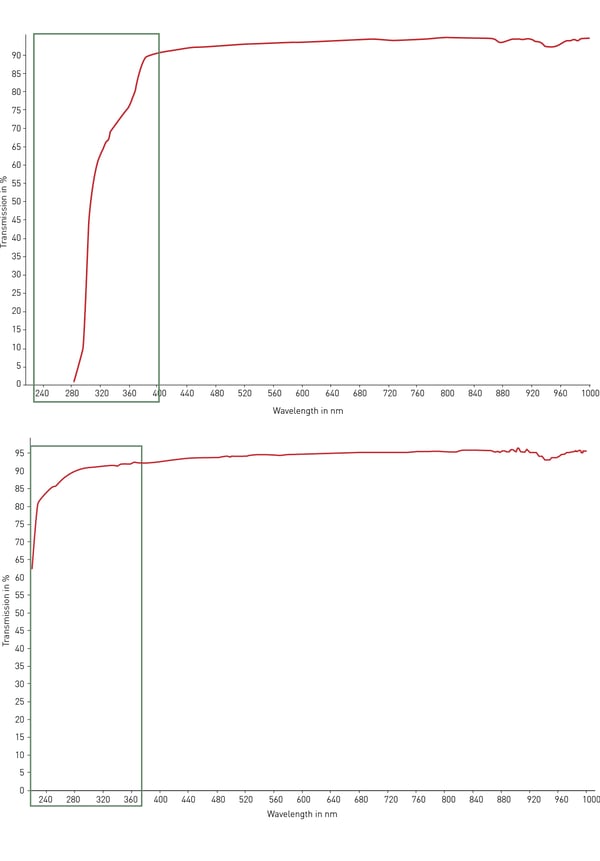 Para aplicações ópticas e de microscopia, bem como para triagem de alto conteúdo, o vidro e o quartzo são os melhores materiais possíveis para transparência, autofluorescência e transmissão de luz. Entretanto, esses materiais são muito caros, frágeis e geralmente não são descartáveis.
Para aplicações ópticas e de microscopia, bem como para triagem de alto conteúdo, o vidro e o quartzo são os melhores materiais possíveis para transparência, autofluorescência e transmissão de luz. Entretanto, esses materiais são muito caros, frágeis e geralmente não são descartáveis.
Além das propriedades ópticas, a absorção de água e a troca de gases desempenham um papel importante nas aplicações baseadas em células. Além disso, as propriedades mecânicas afetam o manuseio, especialmente por sistemas automatizados. As propriedades térmicas podem desempenhar um papel importante em aplicações de alta temperatura (por exemplo, placas de PCR) ou quando são necessários seladores.
O policarbonato e o polipropileno são usados principalmente para placas de PCR (fig. 5) e para amostras sujeitas a grandes mudanças de temperatura (por exemplo, armazenamento a -80°C). Além da estabilidade da temperatura, a resistência a vários solventes e a inércia biológica também são necessárias para fins de armazenamento.
Normalmente, as microplacas são fornecidas em quatro cores: transparente, preta, branca e cinza (fig. 6). Dependendo do modo de detecção utilizado, a cor pode afetar a relação sinal-fundo e o cross-talk entre poços quando amostras muito brilhantes e escuras estão adjacentes. Dessa forma, uma escolha de cor abaixo do ideal pode ter um impacto negativo em seus dados.
 Microplacas transparentes (inclusive transparentes a UV) são necessárias para ensaios de absorção, pois a luz precisa passar pela amostra nesse modo de detecção.
Microplacas transparentes (inclusive transparentes a UV) são necessárias para ensaios de absorção, pois a luz precisa passar pela amostra nesse modo de detecção.
As microplacas pretas (que são escurecidas pela presença de carbono) apagam parcialmente o sinal da amostra. Isso acontece porque a cor preta absorve parcialmente o sinal de luz proveniente da amostra. Consequentemente, essas placas são adequadas para intensidade de fluorescência, incluindo FRET, e para ensaios de polarização de fluorescência. Em geral, esses são modos de detecção com um forte rendimento de sinal, e o uso da cor preta ajuda a reduzir o fundo, a autofluorescência e o cross-talk entre poços, proporcionando melhores proporções de sinal para branco.
Em geral, as microplacas pretas não são recomendadas para ensaios de luminescência, fluorescência resolvida no tempo (TRF) e TR-FRET, porque esses modos de detecção geralmente têm um rendimento de sinal comparativamente baixo que seria ainda mais atenuado pela cor preta. As placas brancas, que incluem dióxido de titânio, são recomendadas para esses ensaios. A cor branca do poço reflete parcialmente o sinal da amostra, ajudando a maximizá-lo. A desvantagem é que as microplacas brancas também aumentam o sinal do branco. Entretanto, esse sinal geralmente é bastante baixo em ensaios luminescentes. Na TRF, a janela de medição atrasada elimina a influência do fundo.
Uma solução intermediária entre o preto e o branco são as microplacas cinza. Elas são recomendadas especificamente para o AlphaScreen® e o AlphaLISA®, pois reduzem o cross-talk e o fundo e ainda fornecem bons sinais.
Se você quiser obter mais detalhes sobre a influência da cor da placa nos resultados da medição em diferentes modos de detecção e quiser ver os dados que comprovam os efeitos, visite a Nota explicativa 6: Como escolher a melhor cor de microplaca para o meu ensaio
Os poços podem ser circulares ou quadrados, sendo que os últimos podem ter cantos retos ou arredondados. Os poços quadrados contêm um volume maior de amostra e aumentam a área de transmissão de luz em comparação com os poços redondos. Os poços redondos têm uma área total menor e são mais adequados para agitação. Além disso, como os poços redondos normalmente não compartilham uma parede comum com os poços adjacentes, eles são menos afetados do que os quadrados pelo sinal cruzado através da parede plástica do poço.
Os fundos dos poços também são fornecidos em diferentes formatos: Fundo em F, V, U e C (fig. 7). Os poços com fundo F (plano) proporcionam a melhor transmissão de luz, são ideais para culturas de células aderentes e são adequados para ensaios de leitura de fundo com leitores de placas ou microscópios.
Os poços com fundo em V (cônicos) permitem a recuperação máxima do volume de amostras pequenas e preciosas devido ao seu formato. Entretanto, o formato cônico é desvantajoso para aplicações espectrofotométricas ou de imagem. Por isso, os poços em forma de V são usados principalmente para armazenamento de amostras e pipetagem precisa.
Um fundo de poço arredondado (fundo em U) facilita a mistura, a lavagem e o revestimento. Os poços com fundo em U permitem uma pipetagem fácil e sem resíduos e são normalmente usados para células em suspensão e esferoides.
Os poços de fundo curvo (fundo C) são um meio-termo entre os poços de fundo F e os de fundo U. O fundo plano os torna adequados para células em suspensão e esferóides. O fundo plano os torna adequados para medições ópticas, enquanto as bordas arredondadas facilitam a mistura e a lavagem.

As propriedades da superfície do poço desempenham um papel importante. Aqui, a amostra e o material do poço interagem entre si. Normalmente, há três tipos principais de microplacas disponíveis: sem ligação ou com baixa ligação, com ligação média e com alta ligação. A ligação é afetada pelas propriedades físicas do material e pode ser modificada pela aplicação de diferentes revestimentos.
Para aplicações de espectroscopia bioquímica e triagem de alto rendimento, o poliestireno sem revestimento é normalmente o material escolhido e classificado como de ligação média.
As placas sem revestimento evitam a ligação de ácidos nucleicos, proteínas e peptídeos à superfície do poço. Nesse caso, um revestimento específico diminui o fundo do ensaio e melhora a relação sinal-ruído.
As microplacas de alta ligação são normalmente usadas para ensaios que exigem a imobilização de moléculas na superfície do poço. Um dos usos mais conhecidos são os ensaios ELISA. Nesse caso, revestimentos e tratamentos específicos introduzem um número definido de grupos hidrofílicos para facilitar a adsorção passiva de biomoléculas (por exemplo, anticorpos). As placas de ligação média e alta geralmente diferem no número de grupos polares disponíveis.
Um exemplo de como o revestimento da placa pode afetar os dados biológicos foi mostrado por meio de um teste de atividade do proteassoma executado com placas sem ligação, com ligação média e com alta ligação. Nesse estudo, os pesquisadores obtiveram resultados diferentes e mostraram que o desempenho do ensaio de proteassoma foi afetado pelas propriedades das microplacas. A atividade do proteassoma foi determinada com um substrato de proteassoma fluorescente, 7-amino-4-metilcumarina (AMC), um marcador amplamente usado para essa finalidade. Como os espectros de excitação e emissão do AMC ligado e não ligado são diferentes, isso permitiu que o AMC livre liberado pela clivagem proteolítica fosse facilmente detectado com um leitor de placas de fluorescência. Entretanto, as curvas padrão de AMC livre apresentaram diferenças significativas entre os três tipos de placas. Como esperado, a placa de alta ligação apresentou o sinal mais baixo. Portanto, diferentes microplacas devem ser avaliadas para determinar a melhor para o ensaio, bem como a função de quaisquer possíveis efeitos específicos da placa.4
O revestimento diferente da placa também pode ter uma influência substancial na formação de meniscos na superfície do líquido, o que pode afetar substancialmente as medições baseadas em absorbância devido a um comprimento de caminho alterado, conforme explicado na Nota explicativa: Como lidar com o comprimento do caminho e o menisco em microplacas.
As placas comuns não podem ser usadas para cultura de células e ensaios baseados em células, pois normalmente não são estéreis. Além da esterilidade, são necessários tratamentos específicos de superfície hidrofílica para facilitar a fixação das células no fundo do poço. Esses tratamentos hidrofílicos são geralmente chamados de "tratados para cultura de tecidos" ou tratados com TC. Há também revestimentos baseados em proteínas da matriz extracelular, como colágeno, fibronectina e laminina, bem como revestimentos sintéticos, como poli-lisinas. Normalmente, é necessária uma superfície repelente de células para células em suspensão, organoides e esferoides.
Como os ensaios celulares às vezes são avaliados durante várias horas ou dias, a evaporação dos poços que contêm células pode influenciar os resultados e, por fim, levar à diminuição da viabilidade celular. Alguns fabricantes oferecem placas que incluem um fosso externo que pode ser preenchido com líquido. Isso ajuda a isolar os poços, evitando assim a evaporação, especialmente dos poços das bordas que apresentam risco de evaporação.
Ao executar ensaios baseados em células, a detecção a partir do fundo do poço geralmente é recomendada por vários motivos. Em placas brancas ou pretas comuns, não é possível fazer a leitura a partir do fundo do poço e é necessário usar fundos transparentes. As paredes dos poços podem ser brancas ou pretas, dependendo do ensaio. O fundo transparente pode ser feito de diferentes materiais, desde plástico (poliestireno ou copolímero de ciclolefina) até vidro ou quartzo. Embora a detecção seja significativamente melhor com o vidro e ainda mais com o quartzo em comparação com o plástico, esses materiais também são muito mais caros. Além disso, as placas de vidro e quartzo não são descartáveis e precisam ser limpas e esterilizadas em autoclave após cada uso. Portanto, é preciso decidir se o melhor desempenho, que vem com um custo mais alto e com mais manutenção, justifica o uso dessa placa em comparação com uma microplaca descartável mais barata e fácil de usar com um fundo de plástico transparente.
Os leitores de microplacas detectam e quantificam os sinais de luz produzidos por amostras líquidas em ensaios baseados em microplacas. Esses instrumentos de laboratório são usados nos setores de ciências da vida e farmacêutico para quantificar reações químicas, biológicas ou físicas. Além das aplicações biológicas, celulares, bioquímicas, farmacêuticas e de descoberta de medicamentos, os leitores de microplacas também são usados em pesquisas ambientais e no setor de alimentos ou cosméticos.
Os leitores de microplacas são fornecidos como instrumentos de modo único ou múltiplo, capazes de quantificar amostras em diferentes modos, como absorbância, intensidade de fluorescência, luminescência e fluorescência resolvida no tempo, TR-FRET, polarização de fluorescência e AlphaScreen. Dependendo do método de seleção do comprimento de onda, os leitores de placas podem ser baseados em monocromadores ou filtros.
Seu uso normalmente melhora a eficiência das práticas laboratoriais e ajuda a economizar custos de reagentes e a reduzir o tempo operacional. Para obter uma visão geral sobre como os leitores de microplacas são usados atualmente, dê uma olhada em nosso banco de dados de notas de aplicação.
Apesar dos padrões ANSI/SLAS, as placas de diferentes fabricantes apresentam pequenas variações nas dimensões e nas posições dos poços. Isso pode influenciar os dados medidos. Mesmo um pequeno deslocamento na profundidade ou na largura da posição do poço em uma linha com 24 ou 48 poços (para uma placa de 384 e 1536 poços, respectivamente) pode fazer com que as medições não sejam mais feitas no centro do poço, mas, na pior das hipóteses, na parede de plástico entre duas amostras.
Assim, os leitores BMG LABTECH vêm com um banco de dados de seleção de microplacas que inclui mais de 50 layouts diferentes de placas de diferentes fabricantes.
Além dos leitores de microplacas, há outros instrumentos diferentes que manipulam ou gerenciam microplacas. Esses instrumentos são usados especificamente na automação de laboratórios. Alguns exemplos incluem manipuladores e lavadores de líquidos usados para dispensar ou remover líquidos de e para diferentes placas, braços robóticos e correias transportadoras para transportar placas entre instrumentos, empilhadores de placas para armazená-las por curtos períodos e hotéis ou incubadoras de placas para armazenamento de longo prazo. Além disso, os seladores e desseladores de placas aplicam e removem as folhas de selagem. Um exemplo de manuseio automatizado pode ser visto no vídeo a seguir:

Coletivamente, os leitores multimodo BMG LABTECH combinam desempenho com ensaios miniaturizados, compatibilidade com opções de manuseio automatizado, tempos de medição curtos e resultam em economia de materiais e outros recursos.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series