
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Entdecken Sie das Potenzial von TR-FRET für präzise, homogene Assays – ideal für die Arzneimittelforschung, die Analyse biomolekularer Interaktionen und zellbasierte Studien.
Zeitaufgelöster FRET (TR-FRET) ist eine Detektionstechnologie, die zeitaufgelöste Fluoreszenz (TRF) mit Förster-Resonanz-Energieübertragung (FRET) kombiniert. TR-FRET wird hauptsächlich zur Analyse von Bindungsereignissen und für das Hochdurchsatz-Screening von Arzneimitteln eingesetzt.
Der Förster-Resonanz-Energie-Transfer beschreibt eine Energieübertragung zwischen zwei Fluorophoren. Er ist nach dem deutschen Wissenschaftler Theodor Förster benannt, der ursprünglich die Theorie des Resonanzenergietransfers entwickelt hat.1 Damit er stattfinden kann, überträgt ein Donor-Fluorophor, das bei der Anregung Energie absorbiert hat und sich in einem elektronisch angeregten Zustand befindet, Energie auf ein zweites Akzeptor-Fluorophor. Durch die Energieübertragung verringert sich die Emissionsintensität des Donors, während sich die Emissionsintensität des Akzeptors erhöht.
Der Energietransfer hängt von zwei Bedingungen ab. Erstens muss die räumliche Nähe zwischen Donor und Akzeptor im Bereich von 20 - 90 Å liegen. Der Resonanzenergietransfer ist umgekehrt proportional zur sechsten Potenz des Donor-Akzeptor-Abstands und reagiert daher sehr empfindlich auf Abstandsänderungen. Zweitens ist eine Überlappung zwischen dem Emissionsspektrum des Donors und dem Anregungsspektrum des Akzeptors erforderlich. "FRET-Paare" benötigen einen ausreichenden Abstand zwischen den Emissionspeaks, um optisch unterscheidbar zu sein, aber gleichzeitig eine ausreichende spektrale Überlappung, um einen effizienten Energietransfer zu ermöglichen (Abb. 1A).
In der Biologie werden am häufigsten genetisch kodierte fluoreszierende Proteine verwendet. Zu den bekanntesten gehören das grün fluoreszierende Protein (Englisch: Green Fluorescent Protein, GFP), das rot fluoreszierende Protein (Englisch: Red Fluorescent Protein, RFP), das türkis fluoreszierende Protein (Englisch: Cyan Fluorescent Protein, CFP) und das gelb fluoreszierende Protein (Englisch: Yellow Fluorescent Protein, YFP).2
FRET wird im Allgemeinen zur Untersuchung molekularer Wechselwirkungen oder Bindungsereignisse verwendet und kann zur Bestimmung der Bindungsaffinität zweier Bindungspartner eingesetzt werden. Diese wird ermittelt, indem jeder zu untersuchende Bindungspartner mit einem Fluorophor verbunden wird und anschließend der Grad des stattfindenden Energietransfers bestimmt wird (Abb. 1 B, C). Da der Standard-FRET jedoch durch das Hintergrundrauschen von gestreutem Anregungslicht und Autofluoreszenz beeinträchtigt wird, sind mit diesem Ansatz kaum hochempfindliche Messungen möglich.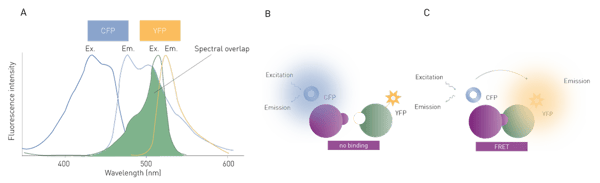
Der zeitaufgelöste FRET eliminiert das kurzlebige Hintergrundrauschen, das von gestreutem Anregungslicht und Autofluoreszenz herrührt, dank der zeitaufgelösten Fluoreszenz und einer zeitverzögerten Detektion. Ermöglicht wird dies durch die Verwendung von Lanthanoiden als Donoren. Diese Fluorophore haben große Stokes-Verschiebungen und ihre Emission hält bis hin zu Millisekunden an.
TR-FRET beruht auf der Resonanzenergieübertragung zwischen einem Lanthanoid und einem konventionellen - kurzlebigen Fluorophor, sofern sie sich in unmittelbarer Nähe befinden. Aufgrund dieser Eigenschaften weist TR-FRET gegenüber dem Standard-FRET eine höhere Stabilität und Spezifität auf. Puffer- oder Medieninterferenzen werden durch die langlebige Fluoreszenz und die ratiometrische Erfassung der beiden Emissionswellenlängen von Donor und Akzeptor erheblich reduziert.
Das allgemeine Assay-Prinzip dieser Technologie ist bei den verschiedenen Kit-Herstellern sehr ähnlich, zu den bekanntesten gehören HTRF®, LANCE®, LanthaScreenTM und THUNDERTM. Donor und Akzeptor sind entweder kovalent an die potentiellen Bindungspartner gekoppelt oder ein spezifischer Antikörper gegen jedes der beiden Zielmoleküle (oder Tags) ist entweder mit dem Donor oder dem Akzeptor markiert. Durch Anregung des Donors wird Energie auf den Akzeptor übertragen, sofern sich die Zielmoleküle in unmittelbarer Nähe befinden. Daraufhin emittiert der Akzeptor aufgrund von Fluoreszenzresonanzenergietransfer. Der Output ist dabei proportional zum Anteil der stattfindenden Bindung.
Bei TR-FRET werden je nach Hersteller verschiedene Fluorophore verwendet, die unterschiedliche Paare bilden.
Lanthanoide werden in der Regel bei 320 - 340 nm angeregt. Die Emission von Europium wird in der Regel bei 620 nm detektiert, während Terbium je nach Kit und Hersteller entweder bei 490 oder 620 nm gemessen wird. Bei Akzeptoren liegt die Emission entweder bei 520 nm für grüne Fluorophore oder bei 665 nm für rote Fluorophore. Die Emission des Donors wird als interne Referenz verwendet, während die Emission des Akzeptors als Indikator für den stattfindenden Energietransfer (Bindungsvorgang) dient (Abb. 3).
Zwischen Anregung und Fluoreszenzdetektion wird eine Zeitverzögerung im Mikrosekundenbereich eingeführt. Dadurch wird die unspezifische kurzlebige Hintergrundfluoreszenz eliminiert. Die Emission wird dann in der Regel über eine Zeitspanne von Mikrosekunden detektiert (Abb. 4). Je nach Kit und Hersteller können die Empfehlungen für die zeitverzögerte Messung und die Länge des Messfensters unterschiedlich ausfallen.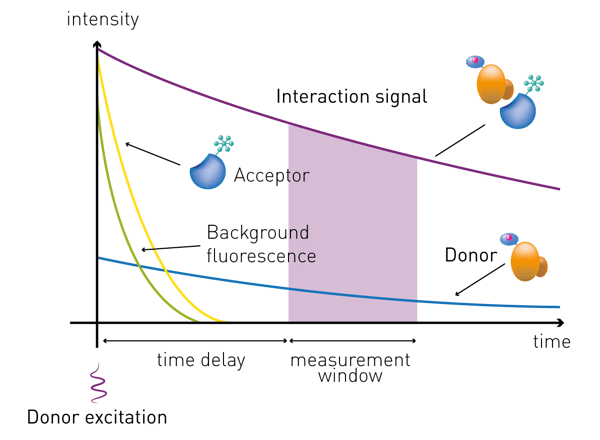 Anschließend wird das Verhältnis der über die Zeit integrierten Signale der beiden Emissionskanäle berechnet. Diese ratiometrische Messung normiert das Signal, eliminiert Störungen durch das Medium und Quenching und korrigiert Fehler, die bei der Handhabung der Reagenzien oder Schwankungen von Well zu Well entstehen.
Anschließend wird das Verhältnis der über die Zeit integrierten Signale der beiden Emissionskanäle berechnet. Diese ratiometrische Messung normiert das Signal, eliminiert Störungen durch das Medium und Quenching und korrigiert Fehler, die bei der Handhabung der Reagenzien oder Schwankungen von Well zu Well entstehen.
TR-FRET-Assays haben durch ihre hohe Empfindlichkeit und Vielseitigkeit stark an Popularität gewonnen. Die Kombination aus zeitaufgelöster Detektion und ratiometrischer Messung vergrößert das Assay-Fenster erheblich und reduziert zudem den Hintergrund. Darüber hinaus bleicht die Lanthanoid-Emission kaum aus, ist zeitlich stabil und mit verschiedenen Reagenzien und Versuchsbedingungen kompatibel.
Neben dieser Vorteile liegt der größte Pluspunkt dieser Methode wahrscheinlich darin, dass der Nachweis des gebundenen TR-FRET-Paares keine physische Trennung von den ungebundenen Komponenten erfordert, um den Hintergrund zu reduzieren. Als so genannter homogener Assay benötigt TR-FRET keine Zwischenschritte zum Waschen und kann als einfacher Add-and-Read-Assay durchgeführt werden (Abb. 5). Dies minimiert die Handhabungsschritte und macht den Assay bequemer und weniger zeitaufwändig als klassische ELISAs. Daher eignet er sich auch besonders für automatisierte HTS-Screening-Kampagnen.
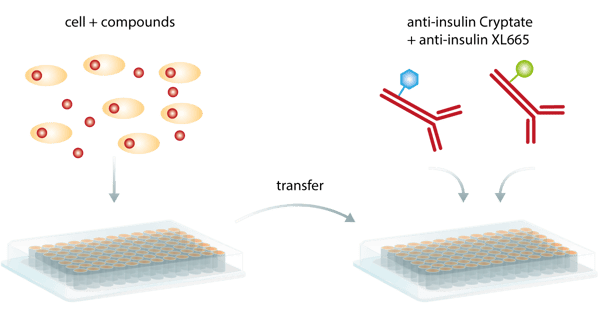
Allerdings kann die Signalreduktion, die durch externe Wechselwirkungen mit dem intramolekularen Anregungsprozess oder der Fluoreszenz von getesteten Wirkstoffen oder biologischen Proteinen entsteht, eine Einschränkung darstellen.3
TR-FRET-Assay-Kits sind von verschiedenen Herstellern erhältlich. Obwohl alle Assays auf einer gemeinsamen Technologie beruhen und alle mit einem Mikroplatten-Reader ausgewertet werden können, gibt es Unterschiede zwischen den Kits und Herstellern. Diese beziehen sich hauptsächlich auf unterschiedliche Donor- und Akzeptor-Typen, deren Kombinationen und unterschiedliche Empfehlungen hinsichtlich der Zeitpunkte für den Beginn der Detektion und des Messfensters.
Alle Assay-Technologien und ihre Charakteristika, einschließlich der Anregungs- und Emissionspeaks, sind in Tabelle 1 zusammengefasst. Neben den beschriebenen Merkmalen unterscheiden sich diese Kits auch in ihren Intervallzeiten und Assay-Fenstern.
Tabelle 1: Vergleich der gängigsten TR-FRET-Assay-Kits und ihrer Anregungs- und Emissionspeaks
| Kit | Donor | Cage-Typ | Anregung | Emission | Akzeptor | Emission |
| LANCE | Europium | Chelat | 320 nm | 620 nm | ULightTM | 665 nm |
| LANCE | Europium | Chelat | 320 nm | 620 nm | Surelight® APC | 665 nm |
| LanthaScreen Eu | Europium | Chelat | 320 nm | 620 nm | AlexaFluor 647 | 665 nm |
| LanthaScreen Tb | Terbium | Chelat | 340 nm | 490 nm | Fluorescein/GFP | 520 nm |
| HTRF Rot (Eu) | Europium | Kryptat | 320 nm | 620 nm | XL665/d2 | 665 nm |
| HTRF Rot (Tb) | Terbium | Kryptat | 340 nm | 620 nm | XL665/d2 | 665 nm |
| HTRF Grün (Tb) | Terbium | Kryptat | 340 nm | 620 nm | Fluorescein/GFP | 520 nm |
| Transcreener | Terbium | Chelat | 340 nm | 620 nm | HiLyte647 | 665 nm |
| THUNDER | Europium | Chelat | 320 nm | 620 nm | Far-Red Farbstoff | 665 nm |
Neben der Verwendung handelsüblicher Kits können TR-FRET-Donor- und -Akzeptor-Paare auch frei kombiniert werden, solange das Emissionsspektrum des Donors eine ausreichende Überlappung mit dem Anregungsspektrum des Akzeptors aufweist. Dies wird in AN 388 gezeigt: Differenzielle Bindung von ∆9-Tetrahydrocannabinol-Derivaten an Typ-1-Cannabinoidrezeptoren (CB1).
Die zeitaufgelöste FRET-Detektion wird überwiegend auf Mikroplatten-Readern durchgeführt. Der Grundaufbau eines TR-FRET-Readers besteht aus einer Lichtquelle, Anregungs- und Emissionsfiltern zur Auswahl der Wellenlängen und einem Photomultiplier-Tube (PMT)-Detektor. Neben dem TRF-Detektionsmodus müssen die Mikroplatten-Reader in der Lage sein, zwei Emissionskanäle in einem Lauf zu messen, entweder nacheinander oder gleichzeitig. Da TR-FRET hauptsächlich im Hochdurchsatz-Screening eingesetzt wird, ist die Kompatibilität mit 384- und 1536-Well-Mikroplatten im Allgemeinen obligatorisch.
Chelat- oder Kryptatkomplexe werden in der Regel bei 320-340 nm angeregt. Daher kann sowohl eine Xenon-Blitzlampe als auch ein spezifischer Anregungslaser als Lichtquelle verwendet werden. Ein TRF-Laser fokussiert mehr Energie auf diesen benötigen Wellenlängenbereich und führt zu besseren Ergebnissen mit besserer Unterscheidung zwischen niedrigen und hohen Signalen.
Der PHERAstar FSX ist mit einem TRF-Laser mit einer Blitzfrequenz von 60 Hertz ausgestattet. Dieser bietet einen erheblichen Geschwindigkeitsvorteil bei der TR-FRET-Detektion. Der Laser ermöglicht die Messung einer vollen 1536-Well-Platte in 36 Sekunden bei einem Z' > 0,8 für Zell- und biochemische Assays (Abb. 7), wie in der Applicatio Note "Cellular and biochemical HTRF assays measured in 1536-well microplates" gezeigt wird.
In der Application Note Excellent assay performance of THUNDER™ TR-FRET cell-based cytokine assays performed on the PHERAstar FSX wird zudem bestätigt, dass der PHERAstar FSX mit TRF-Laser eine wesentlich höhere Empfindlichkeit und einen größeren Dynamikbereich aufweist als ein konkurrierender HTS-Mikroplatten-Reader.
Der PHERAstar FSX ist mit Photonen zählenden Detektoren (PMTs) für die TR-FRET-Detektion ausgestattet. Gewöhnliche Detektoren liefern lediglich einen Integrationswert für die Fläche unter der Kurve während der Integrationszeit. Photonenzählende PMTs hingegen zählen jedes einzelne Photon und überwachen so die gesamte Abklingkurve des Lanthanoid-Signals.
Beim PHERAstar FSX-Reader ermöglicht die Photonenzählung die Messung und Anzeige der Abklingkurve mit einer Zeitauflösung von 2 Mikrosekunden. Diese einzigartige Funktion namens Decay Curve Monitoring vereinfacht die Assay-Entwicklung und hilft bei der Optimierung der Timing-Parameter, verbessert die Detektion und reduziert den Hintergrund. Zusammen mit dem Integration Wizard bietet das Decay Curve Monitoring eine sehr hilfreiche Plattform für die Optimierung von TR-FRET-Assays.
Bei TR-FRET Assays ist die Detektion von zwei Emissionswellenlängen erforderlich, entweder sequentiell oder gleichzeitig. Üblicherweise messen die Mikroplatten-Reader die beiden Emissionen nacheinander. Die gleichzeitige Detektion hat jedoch einige Vorteile.
Das simultane Doppelemissions- (Englisch: Simultaneous Dual Emission - SDE) Detektionssystem des PHERAstar FSX verwendet zwei aufeinander abgestimmte PMTs für die parallele Messung der beiden Emissionswellenlängen. Auf diese Weise verkürzt SDE die Messzeiten um die Hälfte und erhöht den Durchsatz, während gleichzeitig Schwankungen umgangen werden, die durch Unterschiede im Füllvolumen, Konzentrationen oder Schwankungen der Anregungsenergie verursacht werden. Diese Funktion führt zu einer verbesserten Empfindlichkeit und niedrigeren %CVs. Für die ratiometrische Berechnung der Ergebnisse werden die SDE-Einzelkanalmessungen aus beiden Emissionskanälen kombiniert.
Beim Wirkstoffscreening ist die Miniaturisierung von Assays ein bedeutender Schritt. Die Miniaturisierung zielt darauf ab, das Probenvolumen zu verringern und gleichzeitig die Reproduzierbarkeit, Zuverlässigkeit und Robustheit des Assays auf einem guten Niveau zu erhalten. Assays können theoretisch auf 3456-Well-Platten verkleinert werden - am gebräuchlichsten sind jedoch 384- und 1536-Well-Formate.
TR-FRET-Assays lassen sich unter Aufrechterhaltung der Genauigkeit und Reproduzierbarkeit miniaturisieren, da die Signalintensität nicht von der Menge eines Tracers, sondern von dessen Konzentration abhängt. Die Miniaturisierbarkeit wird durch die Verwendung eines hochempfindlichen Mikroplatten-Readers wie dem PHERAstar FSX noch weiter unterstützt.
In dem wissenschaftlichen Vortrag "Successfully downscaling screening assays: Servier's experience" stellen wir eine Fallstudie vor, bei der der PHERAstar FSX Mikroplatten-Reader wesentlich zur erfolgreichen Miniaturisierung eines HTRF-Assays vom 384- auf das 1536-Well-Format beigetragen hat. Auf dem PHERAstar FSX wurde die Miniaturisierung mit einer weiteren Verdünnung der Reagenzien und einer "on-the-fly"-Detektion (nur ein Blitz pro Well) kombiniert. Dieser Ansatz lieferte qualitativ hochwertige Z'-Werte und eine deutliche Reduzierung des Verbrauchs and Reagenzien sowie zu einer deutlichen Zeitersparnis.

TR-FRET wird zur Analyse von Bindungsereignissen in biochemischen Assays eingesetzt. Darüber hinaus eignet es sich für zellbasierte Assays, da Messungen von Zelllysaten inklusive den Bestandteilen von Kulturmedien durchgeführt werden können (homogene Detektion).
Zu den verschiedenen biologischen Fragestellungen zählenProtein-DNA/RNA-Wechselwirkungen, Protein-Protein-Bindungen (Liganden-Rezeptoren), Kinasen und Signalwege einschließlich von GPCRs, Zytokinen und Biomarkern.
TR-FRET ist in der Arzneimittel-Screening-Gemeinschaft wegen seiner Sensitivität, seiner Kompatibilität mit Hochdurchsatzverfahren, seiner Zuverlässigkeit und Flexibilität sowie aufgrund des geringeren Anteils falsch-positiver oder falsch-negativer Ergebnisse besonders beliebt.
Molekulare Wechselwirkungen zwischen Proteinen sowie zwischen Proteinen und Nukleinsäuren finden in einer Zelle auf allen Ebenen statt. Dazu gehören die Epigenetik (z. B.histonmodifizierende Aktivität, wo sie zur Untersuchung der Hemmung von Histondeacetylasen verwendet werden können), die Signaltransduktion (z. B. G-Protein-Aktivierung), die zelluläre Kommunikation (z. B. Ligand-Rezeptor-Interaktion), die Genregulation usw. Protein-Protein-Wechselwirkungen spielen auch eine entscheidende Rolle bei der Funktionsweise von PROteolysis TArgeting Chimeras (PROTACs) oder molekularen Klebstoffen, kleinen Molekülen, die unerwünschte Proteine selektiv dem Protein-Entsorgungssystem der Zelle (Ubiquitin-Proteasom-System) zuführen. Forscher können aus verschiedenen Optionen für zellbasierte Proteinabbauassays wählen. Für die Untersuchung des gezielten Proteinabbaus durch PROTACs und molekulare Klebstoffe können Techniken wie AlphaScreen®, TR-FRET oder Lumineszenz-Methoden wie NanoBRET™ in Mikrotiterplatten durchgeführt werden. Sie ermöglichen die Messung der Interaktion zwischen Target und Ligase. Diese Techniken können auch eingesetzt werden, um den gezielten Proteinabbau zu untersuchen, der durch spezifische Wechselwirkungen zwischen bekannten Degronen und Ligasen entsteht.
In diesem Erfahrungsbericht erläutert Nick Bland von der Firma Domainex, wie der PHERAstar FSX seine biochemische Forschung mit Z`-Werten von 0,9 in HTS TR-FRET-basierten Kampagnen unterstützt.

Die Kinaseaktivität wird hauptsächlich mit Sandwich-Assays analysiert, die die Veränderung des Phosphorylierungsgrades eines Substrats messen, wie in der Application Note "Analysis of ERK1/2, p38αβγ, and STAT3 phosphorylation with the THUNDER™ TR-FRET cellular kinase immunoassays" gezeigt. Es können auch Verdrängungs-Assays verwendet werden, um verschiedene Produkte zu detektieren, die bei der Reaktion entstehen (z. B. ADP). Alternativ werden ein fluoreszenzmarkiertes Kinasesubstrat und ein mit Lanthanoiden markierter Anti-Phospho-Antikörper verwendet (Abb. 8), wie in der Application Note "LanthaScreen TR-FRET Tyrosinkinase- und Proteinkinase-C-Assay" gezeigt. Die genannten Methoden können auch für Proteasen und zur Bestimmung der Ubiquitinierung angewandt werden. Weitere Informationen zum Nachweis von Kinase-Aktivitäten finden Sie in unserem Blogbeitrag "Kinase-Assays".
Assays zur Untersuchung vonG-Protein gekoppelten Rezeptoren (GPCRs) können entweder mechanistisch oder funktionell sein. Funktionelle Assays konzentrieren sich hauptsächlich auf die Quantifizierung von sekundären Botenstoffen (z. B. IP1 oder cAMP), da sich diese in der Zelle infolge der Wirkung spezifischer Inhibitoren anreichern können. Da ihre Konzentration mit der Ligandenbindung und dem Rezeptorbeteiligung korreliert, werden die sekundären Botenstoffe als Indikatoren verwendet, . Dies wird in den Application Notes "HTRF IP-One assay used for functional screening" und "GPCR activation is measured using Cisbio's cAMP and IP1 HTRF HTplex cell-based assay" veranschaulicht. Mechanistische Assays konzentrieren sich auf die Organisation und Oligomerisierung von Rezeptoren an der Zellmembran, um die Signalübertragung zu vermitteln.
Die Analyse nachgeschalteter Signalprodukte kann zur Identifizierung abweichender Signalwege verwendet werden, die möglicherweise eine Rolle bei neurologischen, metabolischen und entzündlichen Krankheiten spielen. TR-FRET kann verwendet werden, um die Wirksamkeit von Substanzen zu testen, die speziell auf diese Krankheiten abzielen. Zu den Anwendungsbeispielen gehören die "Development of a rapid HTRF insulin assay", für Stoffwechselkrankheiten, insbesondere Diabetes mellitus, der "Detection of human tau protein aggregation" beineurodegenerativen Erkrankungen und "Excellent assay performance of THUNDER™ TR-FRET cell-based cytokine assays performed on the PHERAstar FSX"für die Quantifizierung von Zytokinen bei verschiedenen Krankheiten.
In dem wissenschaftlichen Vortrag "Targeting the type 1 cholecystokinin receptor to screen for novel obesity treatments" wird erörtert, wie ein TR-FRET Assay verwendet wurde, um die Akkumulation von Inositolmonophosphat, einem nachgeschalteten Metaboliten von IP3, zu untersuchen. Auf der Grundlage dieser Ergebnisse wurde ein weiterer TR-FRET-basierter Bindungstest entwickelt.

Aufgrund technischer Schwierigkeiten und eines relativ geringen Durchsatzes wurde die Kinetik der Liganden-Rezeptor-Bindung traditionell erst zu einem späten Zeitpunkt der Arzneimittelentwicklung untersucht. Die Die Optimierung der Methodik wäre jedoch für die Arzneimittelforschung von großem Nutzen, da die Kon- und Koff-Raten die Effizienz, das Auftreten von Nebenwirkungen sowie die Wirksamkeit und Wirkdauer von potentiellen Medikamenten beeinflussen. Darüber hinaus scheint die Bindungskinetik eine Rolle bei einem verzerrten Agonismus zu spielen. Es ist daher wünschenswert, die Bindungskinetik von Arzneimittelkandidaten zu einem frühen Zeitpunkt zu untersuchen, bevor man zu In-vivo-Modellen und klinischen Studien übergeht.
Bindungskinetische Studien (Abb. 9) können effizient mit Mikroplatten-Readern durchgeführt werden, die eine kinetische TR-FRET-Detektion für Screening-Zwecke und die kinetische Untersuchung von Verbindungen mit niedriger Affinität ermöglichen, wie in dem wissenschaftlichen Vortrag "A TR-FRET approach to measure the kinetics of ligand-receptor binding and its application of fragment screening" und in der Application Note "Analyze binding kinetics with HTRF" erläutert wird.

Mit seinen einzigartigen Funktionen für kinetische Bindungsstudien ist der PHERAstarFSX allen anderen derzeit auf dem Markt erhältlichen Mikroplatten-Readern überlegen. Dank der Möglichkeit zur hohen zeitlichen Auflösung bei der TR-FRET-Detektion und seinen zielgerichteten Hardware-/Softwarelösungen kann der Reader Bindungsereignisse leicht auflösen und Kon- und Koff-Raten berechnen.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows