
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Messen Sie biolumineszente Blitz- und Glühsignale mit hoher Empfindlichkeit, von Reportergenstudien bis zur ATP-Quantifizierung.
Das Wort Lumineszenz setzt sich zusammen aus "lumin" (lateinisch für Licht) und dem Suffix "-eszenz" (für Prozesse oder Veränderungen). Es handelt sich also um einen Prozess, bei dem Licht freigesetzt wird. Laut Definition stammt die Lumineszenz aus "kalten" Quellen und wird von der Lichtemission "erhitzter" Quellen (Glühen) wie heißem Eisen oder einer brennenden Kerze unterschieden1. Leuchtsignale können bei der Energieumwandlung aus einer breiten Palette von Energiequellen entstehen. Der Prozess wandelt unsichtbare Energie in sichtbare Strahlung um und kann in der Natur als Abwehrmechanismus, für LEDs auf Bildschirmen oder zu Analysezwecken genutzt werden. Der Inhalt dieses Artikels konzentriert sich auf die Verwendung von Lumineszenz-Methoden in den Biowissenschaften, erklärt ihren physikalischen Hintergrund, liefert Informationen über ihren Nachweis auf Lumineszenz Microplate Readern und stellt gängige Lumineszenz-Mikroplatten-Assays vor. Elektrolumineszenz, Radiolumineszenz und Thermolumineszenz sind nicht Teil dieses Inhalts, da sie für dieses Thema nicht relevant sind.
Lumineszenz ist die Erzeugung eines Leuchtsignals durch Energieumwandlung. Ihre Anwendung in den Biowissenschaften stützt sich in erster Linie auf zwei Energiequellen: chemische oder Lichtenergie, die zu Chemo- bzw. Photolumineszenz führt. Letztere ist auch die Grundlage der Fluoreszenz (Phosphoreszenz).
Die Energie einer der beiden Quellen wird von einem Molekül absorbiert und bringt dessen Elektronen auf ein höheres Energieniveau (Abb. 1). Da dieses Niveau instabil ist, fallen die Elektronen aus dem angeregten Zustand in den Grundzustand zurück. Beim Zurückfallen geben die Elektronen Energie in Form von Schwingungsenergie, Wärme und Photonen ab. Letzteres ist die Lumineszenzemission2.
In den Biowissenschaften wird der Begriff "Fluoreszenz" üblicherweise verwendet, wenn von Phosphoreszenz oder Photolumineszenz die Rede ist, während sich "Lumineszenz" in der Regel auf Chemilumineszenz bezieht. Diese Vereinfachung wird durch den Unterschied in der Detektion unterstützt: Fluoreszenz erfordert eine Anregungsquelle, Lumineszenz dagegen nicht (Abb. 2). Dieser Artikel hält sich an diese gängige Nomenklatur und konzentriert sich auf die Chemilumineszenz, die im Folgenden als "Lumineszenz" bezeichnet wird.
Bei dieser Reaktion reagiert ein Substrat in einem elektronisch angeregten Zustand. Die Elektronen des angeregten Produkts oder Zwischenprodukts fallen in ihren niedrigsten Energiezustand, wobei sie Photonen emittieren und somit lumineszieren. Ein typisches Beispiel ist die Reaktion von Luminol in Gegenwart von Wasserstoffperoxid (Abb. 3). In einer alkalischen Umgebung liegt dieses Substrat in einer Form (Dianion) vor, die mit molekularem Sauerstoff O2 reagiert. Das oxidierte Zwischenprodukt reagiert dann zu einer elektronisch angeregten 3-Aminophthalsäure (3-APA). Das Molekül fällt dann in den Energiezustand zurück, den es normalerweise einnimmt, und setzt Licht frei. Dieses einfache Prinzip ist auch die Grundlage für die verstärkte Chemi- und Biolumineszenz. Es handelt sich also ebenfalls um Chemilumineszenz-Reaktionen.
ECL verwendet Verstärker für die Chemilumineszenz-Reaktion. Bei ECL wird hauptsächlich Luminol in Verbindung mit Wasserstoffperoxid verwendet. Die Oxidation wird jedoch durch ein Enzym katalysiert: Meerrettich-Peroxidase (HRP). Zusätzlich enthalten ECL-Reaktionen Chemikalien, die die Lichterzeugung verstärken, wie p-Cumarsäure oder 4-Jodphenylboronsäure. Die Verwendung eines Enzyms zur Katalyse der chemischen Reaktion ermöglicht den Einsatz von ECL in enzymverknüpften Reaktionen. Seine Hauptanwendung sind Immunoblots: Proteine werden nach Größe getrennt, auf eine Membran übertragen und mit ECL nachgewiesen. Die auf der Membran immobilisierten Proteine von Interesse werden durch einen für das Protein spezifischen Antikörper gebunden und ein zweiter, an Meerrettich-Peroxidase gekoppelter sekundärer Antikörper wird verwendet, um den Protein-Antikörper mit HRP zu verbinden. Dank der Enzyme und Verstärker wird nur dort ein helles HRP Signal erzeugt, wo das Protein zu finden ist.
Das gleiche Prinzip wird für die Quantifizierung von Biomolekülen auf Mikroplatten verwendet. ELISA-Tests mit Lumineszenzdetektion haben eine höhere Empfindlichkeit und basieren auf ECL. Das Protein von Interesse wird hierzu in den Wells einer Mikroplatte immobilisiert, und spezifische Antikörper, HRP-gekoppelte Sekundärantikörper, Substrat und Verstärker erzeugen ein Leuchtsignal, das mit der Proteinkonzentration zunimmt.
Biolumineszenz tritt in lebenden Organismen auf. Der Begriff umfasst auch Reaktionen, bei denen Enzyme und Substrate verwendet werden, die ursprünglich aus lebenden Organismen stammen, jedoch außerhalb des Organismus verwendet werden oder durch Bioengineering verbesserte Eigenschaften erhalten. Die Biolumineszenz wird für verschiedene biologische Zwecke genutzt. Glühwürmchen nutzen ihre Fähigkeit zu leuchten, um Partnerinnen anzulocken. Man nimmt an, dass Quallen wie Aequorea victoria oder Tiefseegarnelen die Lichterzeugung nutzen, um biologische Feinde abzuwehren. Beim Quorum Sensing erzeugen Bakterien wie das marine Vibrio fischeri ein Leuchtsignal, wenn sie eine bestimmte Wachstumsdichte erreichen. Dies ermöglicht es der Population, zu kommunizieren und sich zu koordinieren.
Aber wie schaffen es diese Organismen, zu leuchten? Durch ein Enzym (Luciferase), das die Oxidation von Substraten (Luciferinen) katalysiert und dabei Photonen freisetzt. Verschiedene Organismen verwenden unterschiedliche Enzyme und Substrate. Außerdem sind für die lichtemittierenden Reaktionen unterschiedliche Kofaktoren erforderlich, was zu unterschiedlichen Wellenlängen führt. Abbildung 4 zeigt drei Reaktionen weit verbreiteter Luciferasen in biowissenschaftlichen Versuchen.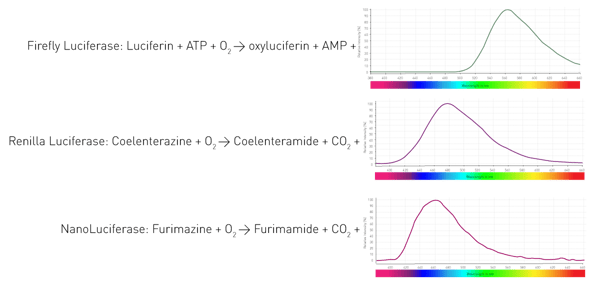
Der Resonanzenergietransfer beschreibt die Übertragung von Energie von einem elektronisch angeregten Donor-Molekül auf ein Akzeptor-Fluorophor. Der Prozess regt das Akzeptor-Fluorophor an, das seinerseits Photonen emittiert. Wenn die Donorenergie durch Biolumineszenz erzeugt wird, nennt man den Prozess Biolumineszenz-Resonanzenergietransfer (BRET). Um den Transfer zu ermöglichen, müssen verschiedene Bedingungen erfüllt sein: Das Emissionsspektrum des Donor-Moleküls muss sich mit dem Anregungsspektrum des Akzeptor-Fluorophors überschneiden. Außerdem müssen sich Donor und Akzeptor in unmittelbarer Nähe zueinander befinden (typischerweise innerhalb von 1-10 nm), da die Übertragung mit der Entfernung abnimmt. Daher wird BRET üblicherweise zur Messung der Wechselwirkung zweier Biomoleküle verwendet. Das Ergebnis einer BRET Messung ist die Intensität des Akzeptor-Fluorophors im Verhältnis zur Intensität des Donors, auch bekannt als BRET-Verhältnis oder BRET-Ratio. BRET1, BRET2 und NanoBRET verwenden unterschiedliche Kombinationen von Enzymen und Akzeptor-Fluorophoren (siehe Tabelle 1).
Tabelle 1 - Arten von BRET
| Bezeichnung | Donor-Luciferase | Substrat | Donor-Emission | Akzeptor-Fluorophor | Akzeptor-Emission |
| BRET 1 |
Renilla |
Coelenterazin |
450-500 nm |
YFP | 515-560 nm |
| GFP |
510-540 nm | ||||
| BRET 2 | Renilla | DeepBlueC | 400-450 nm | GFP | 500-540 nm |
| NanoBRET | NanoLuc | Furimazin | 420-500 nm | NanoBRET 618 | 550-675 nm |
| TMR | 550-600 nm | ||||
| AlexaFluor 633 | 600-700 nm | ||||
| Venus | 515-575 nm |
Lumineszenz-basierte Assays für biowissenschaftliche Anwendungen verwenden entweder Flash- oder Glow-Reaktionen. Der Unterschied zwischen den beiden besteht in der Dauer des Signals. Flash-Assays erzeugen ein Signal für maximal ein paar Sekunden. Die Intensität des erzeugten Lichtblitzes wird in der Regel direkt vom Beginn bis zum Ende der Reaktion aufgezeichnet. Dies bedeutet, dass Flash-Reaktionen durch die Zugabe eines Reaktionsstarters gestartet werden müssen. Bei Microplate Readern werden Reagenzieninjektoren benötigt, um die Reaktion automatisch zu starten und gleichzeitig das Signal aufzuzeichnen. Beliebte Flash-Lumineszenz-Assays umfassen die Dual-Luciferase Reporter™-Technologie oder SPARCL-Assays.
Im Gegensatz zur Flash-Lumineszenz erzeugt die Glow-Lumineszenz stabile Signale für bis zu mehrere Stunden. Diese Assays erfordern keinen automatisierten Reaktionsstart und können über einen längeren Zeitraum ausgelesen werden. Sowohl Forscher als auch Anbieter von Kits bevorzugen Glow-Assays, da sie einfacher zu handhaben und nachzuweisen sind. Einer der bekanntesten Vertreter der Glow-Lumineszenz ist der Zellviabilitätstest CellTiterGlo®.
Abgesehen von der ECL-Detektion in Western Blots werden Lumineszenztests typischerweise in Mikroplatten (6- bis 1536-Well-Formate) durchgeführt und mit einem Microplate Reader quantifiziert. In diesem Abschnitt wird erläutert, wie die Lumineszenz in Mikroplatten gemessen wird.
Lumineszenz ist einfacher zu detektieren als Fluoreszenz oder Absorption, da keine Anregungsenergie erforderlich ist. Das bedeutet, dass weder eine Lichtquelle noch eine Auswahl der Anregungswellenlänge erforderlich sind. Die minimal erforderlichen Komponenten sind eine Linse zum Sammeln des Lichtsignals und ein Detektor (Abb. 5). Für die Messung von BRET ist ein Wellenlängenauswahltool erforderlich, und für spezielle Detektionskonstruktionen können Lichtleiter notwendig sein.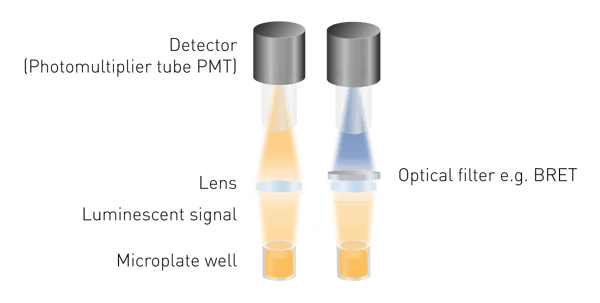
Photomultiplier-Tubes (PMTs) dienen als Detektoren bei der Lumineszenz-Detektion. PMTs unterscheiden sich durch ihre Empfindlichkeit (das niedrigste nachweisbare Signal), ihr Rauschen und ihre Fähigkeit, andere Detektionsarten zu messen. Viele Messgeräte sind mit einem universellen PMT ausgestattet, der sowohl Lumineszenz als auch andere Detektionsmodi messen kann. Ihre Vorteile sind ein geringer Platz- und Kostenbedarf bei hoher Empfindlichkeit. Die Möglichkeit, sehr niedrige Signale zu messen, wird durch optimierte optische Systeme geboten. Ein solches optimiertes System ist der optische Freiluftpfad in Kombination mit einem Lumineszenz-Plus-Optikmodul, das in den PHERAstar FSX-Mikroplattenlesegeräten zu finden ist.
 b) Lichtleiter
b) LichtleiterIm Idealfall befindet sich der Detektor möglichst nahe direkt über dem zu vermessenden Well einer Mikroplatte. Wenn dies nicht möglich ist, muss das Lichtsignal vom Well zum Detektor geleitet werden. Diese Aufgabe kann entweder durch Linsen und Spiegel oder durch einen Lichtleiter erfüllt werden. Der Lichtleiter absorbiert einen Teil der Lumineszenz, wodurch sich die Empfindlichkeit im Vergleich zu einem optischen Pfad in freier Luft verringert. Letzteres ist bei den Microplate Readern VANTAstar, CLARIOstar Plus und PHERAstar FSX zu finden.
Bei einigen Anwendungen ist es für optimale Ergebnisse erforderlich, nur bei einer bestimmten Wellenlänge zu detektieren. Dies wird durch optische Filter oder Monochromatoren erreicht, die in den optischen Pfad eingesetzt werden. BRET-Messungen erfordern eine Auswahl der Wellenlänge, da zwei Signale von ein und derselben Probe stammen. Um zwischen dem vom Donor-Luminophor und dem vom Akzeptor-Fluorophor stammenden Licht zu unterscheiden, werden zwei Filter benötigt.
Herkömmliche Monochromatoren auf Gitterbasis spielen bei der gefilterten Lumineszenz und der BRET-Messung aufgrund ihrer begrenzten Empfindlichkeit eine untergeordnete Rolle. Dies ist auf Streueffekte und enge Bandbreiten zurückzuführen. Monochromatoren mit linearen variablen Filtern (LVF) bietet jedoch die erforderliche Empfindlichkeit. Ein LVF-basierter Monochromator weist eine filterähnliche Transmission auf und bietet Bandbreiten von bis zu 100 nm. Dadurch wird sichergestellt, dass genügend Signal den Detektor für gefilterte Lumineszenz wie BRET erreicht (Abb. 7).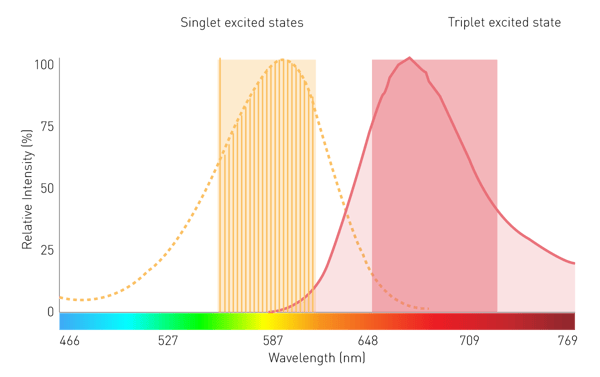
Ein Lumineszenzsignal dauert eine Sekunde oder länger und unterscheidet sich daher deutlich von Fluoreszenz, die in Nanosekunden abklingt. Dementsprechend wird das Signal typischerweise über einen Zeitraum zwischen 0,1 und 1 Sekunde erfasst. Diese Zeit hat verschiedene Bezeichnungen: Messzeit, Integrationszeit und Messintervallzeit. Sie hängt von mehreren Aspekten ab, die gegeneinander abgewogen werden müssen, z. B. von der Signalintensität und der Gesamtzeit für das Ablesen einer Platte.
Die Lumineszenzmessung in Mikroplatten-Readern ist relativ einfach, da sie in der Regel nur wenige Einstellungen erfordert. Allerdings gibt es gerätebezogene und allgemeine Variablen, die sich auf die Messungen und die Datenqualität auswirken.
Wie bereits erwähnt, hängt die Erfassungszeit von mehreren Faktoren ab. Die folgenden Aspekte sollten bei der Wahl der Integrationszeit berücksichtigt werden:
Die meisten Assays emittieren so viel Licht, dass ein Signal in einer halben bis 0,02 Sekunden erfasst werden kann. Nur sehr selten ist es notwendig, die Integrationszeit auf einige Sekunden zu erhöhen, um Unterschiede in den Lumineszenzsignalen zu erkennen.
Glow-Signale werden in der Regel 0,1 bis 1 Sekunde lang erfasst, da sie ein stabiles Signal aussenden. Daher spielen die gesamte Plattenlesezeit sowie der Zeitpunkt und die Dauer der Signalmessung eine untergeordnete Rolle. Dies ist bei Flash-Assays anders. Hier ist es wichtig, das gesamte Emissionssignal von Anfang bis Ende zu erfassen, was je nach Assay mehrere Sekunden dauern kann.
Wenn es wichtig ist, zu wissen, wie die Signalkurve aussieht und wie hoch die maximale Emission einer Flash-Reaktion ist, sind mehrere Messungen bei sehr niedrigen Integrationszeiten erforderlich. Wenn eine Reaktion beispielsweise etwa eine Sekunde dauert, können 50 Messungen von 0,02 s durchgeführt werden, um eine Sekunde abzudecken und zu beobachten, wie sich das Signal entwickelt und abklingt.
Dieser Punkt ist nur für kinetische Messungen von Bedeutung. Wenn eine zellbasierte oder biochemische Reaktion mit einem Lumineszenztest überwacht wird, bestimmt der zeitliche Verlauf der Reaktion die Integrationszeit. Bei Calcium-Assays beispielsweise treten Reaktionen in einem Bereich von 20 Sekunden nach der Stimulation auf und können durch 10 Messungen alle 2 Sekunden angezeigt werden. Wenn nur ein Well einer Mikroplatte gemessen wird, kann eine Integrationszeit von 1 oder 2 s gewählt werden, was zu einer angemessenen zeitlichen Auflösung führt. Müssen jedoch mehrere Wells auf einer Mikroplatte mit der gleichen zeitlichen Auflösung (Messpunkt für jedes Well alle 2 Sekunden) gemessen werden, muss die Integrationszeit verringert werden, um die verbleibenden Wells zu messen und Datenverluste zu vermeiden.
Da die Integrationszeit auf jedes Well einer Mikroplatte angewendet wird, trägt sie wesentlich zur Gesamtlesezeit einer Platte bei. Erhöht man die Integrationszeit für jedes Well um nur 0,2 s, erhöht sich die Gesamtlesezeit einer vollen 96-Well-Platte um 20 s, bei einer 384-Well-Platte um mehr als eine Minute. Daher ist es wichtig, bei Platten mit hoher Dichte (384- oder 1536-Well-Platten) und bei Anwendungen mit hohem Durchsatz, bei denen Tausende von Platten an einem Tag gemessen werden müssen, niedrige Integrationszeiten zu verwenden.
Die Gain-Einstellung kann als ein Verstärkungsfaktor betrachtet werden, der ein festes Dynamikfenster entlang der Konzentrationskurve der Probe verschiebt. Proben mit niedriger Signalintensität erfordern eine größere Signalverstärkung durch höhere Gain-Werte, während intensive Signale niedrigere Gain-Werte benötigen. In der Regel wird der Gain so eingestellt, dass die maximale Messleistung bei der Probe mit der erwarteten höchsten Intensität erreicht wird. Dies geschieht, um ein möglichst großes dynamisches Fenster zwischen den höchsten und den niedrigsten Messwert auf einer Mikroplatte zu erhalten. Wenn also positive Kontrollen mit einem maximalen Signal zusammen mit unbekannten Proben verwendet werden, kann die Verstärkung an diesen angepasst werden.
Die Möglichkeit, mit unterschiedlichem Gain zu messen ermöglicht die Messung sehr niedriger Signale und heller Emissionen über einen großen dynamischen Bereich mit nur einem Gerät.
Gain-Einstellungen sind nicht für alle Lumineszenz-Microplate Reader erforderlich und hängen vom Detektor und der Automatisierung des Gain-Einstellungsprozesses ab.
Moderne Lumineszenz-Plate Reader führen die Gain-Einstellung automatisch durch. Dies nimmt dem Forscher nicht nur diese Verantwortung ab, sondern gewährleistet auch einen breiten dynamischen Bereich. Solche Geräte sind der CLARIOstar® Plus und der VANTAstar® mit seiner Enhanced Dynamic Range Technologie.
Weiße Platten eignen sich am besten für Lumineszenzmessungen, da sie das Probensignal reflektieren, anstatt es zu absorbieren. Weitere Details zur Plattenwahl finden Sie in unserem Blogbeitrag:"Die Mikroplatte: Nutzen in der Praxis".
Sollten Lumineszenz- und Fluoreszenz-Assays im selben Well einer Mikroplatte kombiniert werden wird empfohlen schwarze Platten zu verwenden. Die Messung der Fluoreszenz in einer weißen Platte führt zu sehr instabilen Werten und einem sehr hohen Hintergrundsignal aufgrund der Reflexion des Anregungslichts. Dies macht den Fluoreszenznachweis in weißen Platten recht problematisch. Die Messung der Lumineszenz in schwarzen Platten verkleinert das Assay-Fenster. Da jedoch der Hintergrund stark reduziert ist und die Messungen geringere Abweichungen aufweisen, sollten die Messungen dennoch zufriedenstellende Ergebnisse liefern.
Als Crosstalk bezeichnet man das Licht aus einem anderen als dem gemessenen Well einer Mikroplatte, das vom Detektor unspezifisch gemessen wird und das Signal der tatsächlich gemessenen Wells verändert. Es ist ein Phänomen, das nur die Lumineszenzdetektion betrifft.
Da das bei einer Lumineszenzreaktion erzeugte Licht diffus ist, kann es nicht nur direkt über dem Well leuchten, sondern auch in benachbarte Wells und direkt zum Ort der Detektion streuen, auch wenn eine anderes Well gemessen wird. Dies führt zu verzerrten Signalen, höheren Schwankungen und einer geringeren Gesamtempfindlichkeit. Das Problem kann je nach Reaktionstyp und Streuung des Signals auf unterschiedliche Weise gelöst werden.
Bei Flash-Assays, die nur wenige Sekunden lang leuchten, genügt es, die Platte in einer anderen Reihenfolge zu messen. Da das Signal schnell abklingt, sind die einzigen Wells einer Mikroplatte, die von Crosstalk betroffen sind, die benachbarten, wenn sie direkt nacheinander gemessen werden. Wird eine entferntes statt einem benachbarten Well gemessen, wird der Crosstalk drastisch verringert, da das abklingende Signal an der entfernten Stelle nicht mehr nachweisbar ist. Zu diesem Zweck bieten die BMG LABTECH Microplate Reader einen Zeilensprung-Modus. In diesem Modus wird jedes zweite Well einer Mikroplatte gemessen, bis das Ende der Platte erreicht ist. Dann werden die ausgelassenen Zonen gemessen. So können die zuerst gemessenen Signale abklingen, bis ihre direkten Nachbarn gemessen werden.
Glow-Assays geben über Stunden hinweg stabile Signale ab und erfordern andere Strategien, um Übersprechen zu vermeiden. Unerwünschte Signale können auf zwei Wegen zum Nachweisort gelangen: über die Platte und durch die Wand benachbarter Wells einer Mikroplatte (Abb. 8). Beide Wege müssen unterschiedlich angegangen werden.
Blenden blockieren physisch das unerwünschte Licht, das über die Wells in den Detektor scheint. Eine Blende ist ein schwarzes löffelförmiges Zubehörteil mit einem Loch, das über der Mikroplatte angebracht wird (Abb. 8). Durch das Loch gelangt das Signal des untersuchten Wells zum Detektor, während das gesamte Licht umliegender Wells physikalisch blockiert wird. BMG LABTECHs Multimode-Microplate Reader PHERAstar® FSX sowie VANTAstar® und CLARIOstar® Plus sind mit Blenden für eine verbesserte Lumineszenzdetektion ausgestattet.
 b) Reduzierung des mathematischen Crosstalks
b) Reduzierung des mathematischen CrosstalksSelbst in weißen Mikrotiterplatten kann Licht durch die Kunststoffwand eines Wells scheinen. Die Art der Mikrotiterplatte hat einen erheblichen Einfluss auf diesen Crosstalk, der durch die Wände der Wells einer Mikroplatte scheint. Im Allgemeinen weisen Platten mit höherer Dichte (z. B. 1536 Vertiefungen) einen höheren Lichtdurchlass durch die Wände auf als Platten mit geringerer Dichte, da ihre Wände dünner sind. Ein zweiter Aspekt ist die Well-Geometrie: quadratische Vertiefungen weisen einen höheren Crosstalk durch die Wand auf, da benachbarte Wells eine gemeinsame Wand teilen. Runde Vertiefungen haben keine gemeinsame Wand und weisen daher einen geringeren Crosstalk durch die Wand auf. Außerdem beeinflusst die Farbe der Platte den Crosstalk durch die Mikroplattenwände: je dunkler die Platte, desto geringer der Crosstalk. Graue Platten bieten einen Kompromiss zwischen der Reduzierung des Crosstalks und der Signalreflexion.
Wenn es nicht möglich ist, die Platte weiter zu optimieren, kann eine mathematische Crosstalk-Reduktion auf die gewonnenen Daten angewendet werden. Zu diesem Zweck wird der Crosstalk zu benachbarten Wells einer Mikroplatte bestimmt und ein Algorithmus korrigiert die Daten. Eine automatische Bestimmung und Korrektur des Crosstalks findet sich in den BMG LABTECH Plate Readern PHERAstar® FSX, VANTAstar® und CLARIOstar® Plus.
Weiße Mikroplatten haben eine intrinsische Phosphoreszenz: Die Platte selbst emittiert Licht, wenn sie belichtet wird. Dieses Signal kann die Daten verfälschen, indem es die Leerwerte erhöht und das Testfenster verkleinert. Es wird daher empfohlen, weiße Platten im Dunkeln vorzubereiten oder sie etwa 15 Minuten vor der Messung im Dunkeln zu lassen.
Filter werden hauptsächlich für BRET-Messungen benötigt. Da Lumineszenz oft geringe Signalintensitäten aufweist, wird empfohlen, Filter mit einer breiten Bandbreite von 80 - 100 nm zu verwenden. Breitere Bandbreiten führen dazu, dass mehr Licht zum Detektor durchdringt, und erhöhen somit die Empfindlichkeit der Messung.
Bei Reporter-Assays werden genregulatorische Sequenzen in Kombination mit der genetischen Information eines Reporterenzyms verwendet, um entweder Veränderungen in der Genexpression oder Veränderungen in regulatorischen Genregionen selbst zu untersuchen. Die genetische Information des Reportergens muss in die Zellen eingebracht werden. Wenn das Reportergen aktiv ist, wird das Enzym transkribiert und übersetzt. In Anwesenheit eines Substrats generiert das Reporterenzym ein Lumineszenzsignal, dessen Emission über die Aktivität der regulatorischen Sequenzen Auskunft gibt.
Die Dual-Luciferase-Reporter-Assays (DLR™) fügen dem System einen zweiten Reporter hinzu. Neben dem Reporter, der an die gewünschte regulatorische Sequenz gekoppelt ist, dient eine zweite Luciferase, die von einem "Housekeeping"-Promotor gesteuert wird, als interne Kontrolle. Mit dem CLARIOstar oder dem VANTAstar und ihrer Lumineszenz-Scanning-Option ist es möglich, passende Luciferasen zu identifizieren und z. B. bis zu sechs Luciferasen in einem einzigen Multiplex-Luciferase-Assay zu kombinieren.
Der am weitesten verbreitete Zellviabilitäts-Assays basiert auf der Firefly-Luciferase. Seine Aktivität nimmt mit steigendem ATP-Gehalt zu und damit auch die Lichtemission. Lebensfähige Zellen produzieren ATP, das nach der Zelllyse die Reaktion antreibt. Dementsprechend korreliert die Emission mit der Zellzahl und der Viabilität. Zusätzlich zu den ATP-basierten Endpunkt-Viabilitäts-Assays können Lumineszenztests die Zelllebensfähigkeit in Echtzeit messen. Zu diesem Zweck werden der Zellkultur ein Pro-Substrat sowie das Firefly-Enzym zugesetzt. Das Pro-Substrat wird nur von lebensfähigen Zellen reduziert und dann in einer lichtemittierenden Reaktion verarbeitet. Auf diese Weise gibt die Lumineszenz in Echtzeit Auskunft über Veränderungen der Zellviabilität. Mehr über diese Assays erfahren Sie in unserem wissenschaftlichen Vortrag "Real-time cell health assays deliver better data with less effort". Zellviabilitäts-Assays sind auch für die Arbeit mit PROteolysis TArgeting Chimeras (PROTACs) und Molecular Glues beim gezielten Proteinabbau für die Arzneimittelforschung von Bedeutung. Dazu gehört auch die Forschung im Bereich des gezielten Proteinabbaus, der sich aus spezifischen Wechselwirkungen zwischen bekannten Degronen und Ligasen ergibt.

Der Zellstoffwechsel umfasst verschiedene Schritte der molekularen Umwandlung. Viele der verfügbaren Assays zum Nachweis zellulärer Stoffwechselvorgänge basieren auf Lumineszenz. Der Grundstoffwechsel konzentriert sich auf die Verwendung von Hauptnährstoffen wie Glukose. Der Glukoseverbrauch kann zum Beispiel mit dem Glukose-Glo-Assay verfolgt werden. Zur indirekten Messung des Glukoseverbrauchs kann auch das Abbauprodukt von Glukose - Laktat - mit dem Laktat-Glo-Assay nachgewiesen werden. Die Leistungsfähigkeit beider Assays wird in der AppNote: Glucose assay and lactate assay allow to monitor cellular glucose metabolism precisely in a cell-based assay demonstriert. In der AppNote: ROS detection in a cell-based format using the Promega ROS-Glo™ assay wird die Verwendung eines lumineszenzbasierten Assays zum Nachweis von übermäßig produzierten reaktiven Sauerstoffspezies gezeigt.
Rezeptoren sind häufige Zielstrukturen für Arzneimittel und ihre Liganden sind mögliche Therapeutika. Die Bindung von Liganden an ihre Rezeptoren kann in zellbasierten Assays nach dem BRET-Prinzip untersucht werden. Die Luciferase wird am extrazellulären Teil des Rezeptors exprimiert, und ein Ligand wird mit einem geeigneten Akzeptor-Fluorophor markiert. Bindet der Ligand an seinen Rezeptor, sind Donor und Akzeptor nahe genug beieinander, um Energie zu übertragen, und die BRET-Ratio vergrößert sich. Die Methode ermöglicht auch die Untersuchung der Rezeptorbindung von nicht markierten Verbindungen. Diese können mit einem bekannten Liganden, der mit einem Fluorophor markiert ist, um die Bindung konkurrieren. Wenn das BRET-Verhältnis in einem solchen kompetitiven Aufbau abnimmt, hat eine unmarkierte Verbindung das Akzeptormolekül verdrängt, was zu einem Verlust des Transfers führt (Abb. 9).
Wie diese Assays bei der Untersuchung der Rezeptorpharmakologie helfen, wird in unserem wissenschaftlichen Vortrag "Real-time profiling of receptor pharmacology" erläutert.

Das Prinzip von BRET wird auch zur Untersuchung der Interaktion zweier Proteine verwendet. Zu diesem Zweck wird eines der interagierenden Proteine an die Luciferase gekoppelt, das andere an ein Akzeptor-Fluorophor. Bei der Interaktion beider Proteine findet ein Energietransfer statt, der zur Emission des Fluorophors und zu einem Anstieg der BRET-Ratio führt. Dies kann zum Beispiel zur Untersuchung der Dissoziation von G-Proteinen und der β-Arrestin-Rekrutierung verwendet werden. Eine alternative Methode zur Untersuchung von Interaktionen mit Hilfe von Lumineszenz ist das HiBiT CETSA, das in der Application Note: Measuring protein ligand binding with an endogenous HiBiT CETSA test system beschrieben wird. Bei diesem Ansatz wird eine fragmentierte HiBiT-Nanoluciferase verwendet, die mit einem Zielprotein von Interesse (POI) fusioniert ist, und kann zum Screening auf PROteolysis TArgeting Chimeras (PROTACs) und Molecular Glues beim gezielten Proteinabbau verwendet werden. Diese Art von Ansatz ist auch für die Untersuchung des gezielten Proteinabbaus relevant, der durch spezifische Wechselwirkungen zwischen bekannten Degronen und Ligasen entsteht. Während unter physiologischen Bedingungen die fragmentierte Luciferase zu einem funktionsfähigen Enzym, das ein Lumineszenzsignal generiert, vervollständigt werden kann, verhindert die Anwendung von Hitze diesen Effekt aufgrund der Denaturierung des POI. Die Bindung eines Liganden erhöht die thermische Stabilität des POI, was zu einer messbaren Verschiebung seines Schmelzpunktes führt.
Neben der Protein-Protein-Wechselwirkung kann das BRET-Prinzip auch für den Nachweis von Biomolekülen eingesetzt werden und als Biosensor fungieren. In diesem Beispiel wurde die unterschiedliche Aktivierung von G-Proteinen durch synthetische Cannabinoidrezeptor-Agonisten unter Verwendung des CAMYEL BRET-Biosensors untersucht.
Lumineszenz-Microplate Reader-Assays sind oft empfindlicher als ihre Gegenstücke, die auf anderen Messmethoden beruhen. So sind Lumineszenz-ELISAs und Viabilitäts-Assays empfindlicher als kolorimetrische bzw. Absorbanz-basierte Assays. Außerdem bieten sie Lösungen für eine Vielzahl biologischer Fragestellungen. Aufgrund ihrer Empfindlichkeit werden sie in hohem Maße als Hochdurchsatzanwendungen (HTS) eingesetzt. Für ihren Nachweis sind Instrumente erforderlich, die ebenso empfindlich sind wie die Methode selbst. Ein Vorteil der Lumineszenz für Nicht-HTS-Anwendungen ist die Verfügbarkeit homogener Assays, die auf einem Add-and-Measure-Prinzip beruhen, wodurch die Assays einfach und schnell zu verarbeiten sind. Darüber hinaus ermöglicht eine Vielzahl von Echtzeit-Lumineszenz-Assays die Quantifizierung zellulärer Prozesse, in Real-Time.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series