
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Libérez la puissance du TR-FRET pour des tests hautement sensibles et homogènes dans la découverte de médicaments, les interactions biomoléculaires et la recherche cellulaire.
Le FRET résolu en temps (TR-FRET) est une technologie de détection qui combine la fluorescence résolue en temps (TRF) et le transfert d'énergie par résonance de Förster (FRET). Le TR-FRET est principalement utilisé pour analyser les événements de liaison et pour le criblage à haut débit de médicaments.
Le transfert d'énergie par résonance de Förster décrit le transfert d'énergie entre deux fluorophores.1 Il porte le nom du scientifique allemand Theodor Förster, qui a développé la théorie du transfert d'énergie par résonance.
Pour qu'il ait lieu, un fluorophore donneur, qui a absorbé de l'énergie lors de l'excitation et se trouve dans un état électroniquement excité, transfère de l'énergie à un second fluorophore accepteur. Ce transfert d'énergie réduit l'intensité d'émission du donneur tout en augmentant celle de l'accepteur.
Le transfert d'énergie dépend de deux conditions : premièrement, la proximité spatiale entre le donneur et l'accepteur doit se situer entre 20 et 90 Å. Le transfert d'énergie par résonance est inversement proportionnel à la sixième puissance de la distance entre le donneur et l'accepteur ; il est donc très sensible aux changements de distance. Deuxièmement, un chevauchement entre le spectre d'émission du donneur et le spectre d'excitation de l'accepteur est nécessaire. Les « paires FRET » nécessitent une distance suffisante entre les pics d'émission pour pouvoir être distinguées optiquement, mais aussi un chevauchement spectral suffisant pour permettre un transfert d'énergie efficace (voir la figure 1A).
En biologie, les protéines fluorescentes codées génétiquement sont les plus couramment utilisées. Les plus populaires sont la protéine fluorescente verte (GFP), la protéine fluorescente rouge (RFP), la protéine fluorescente cyan (CFP) et la protéine fluorescente jaune (YFP).2
Le FRET est généralement utilisé pour étudier les interactions moléculaires ou les événements de liaison et peut être employé pour déterminer l'affinité de liaison de deux partenaires. Il permet d'étudier les interactions moléculaires ou les événements de liaison, et de déterminer l'affinité de liaison de deux partenaires. Elle consiste à lier chaque partenaire de liaison à étudier à un fluorophore, puis à détecter le niveau de transfert d'énergie qui a lieu (voir la figure 1 B et C). Cependant, étant donné que la FRET standard est affectée par le bruit de fond provenant de la lumière d'excitation diffusée et de l'autofluorescence, il est difficile d'obtenir des mesures très sensibles avec cette approche.
Le FRET résolue en temps élimine le bruit de fond de courte durée, issu de la diffusion de la lumière d'excitation et de l'autofluorescence, grâce à l'utilisation de la fluorescence résolue en temps et à l'introduction d'une détection retardée dans le temps. Cela est possible grâce à l'utilisation de lanthanides en tant que donneurs. Ces fluorophores présentent de grands décalages de Stokes et des durées de vie d'émission pouvant atteindre plusieurs millisecondes.
Le TR-FRET repose sur le transfert d'énergie par résonance entre un lanthanide et un fluorophore à courte durée de vie, lorsqu'ils sont proches l'un de l'autre. Grâce à ces propriétés, la stabilité et la spécificité du TR-FRET sont améliorées par rapport au FRET standard. L'interférence du tampon ou du milieu est considérablement réduite par la fluorescence à longue durée de vie et par la détection ratiométrique des deux longueurs d'onde d'émission du donneur et de l'accepteur.
Le principe général de l'application de cette technologie est très similaire chez les différents fabricants de kits, dont les plus connus sont HTRF®, LANCE®, LanthaScreenTM et THUNDERTM. Le donneur et l'accepteur sont soit liés de manière covalente aux partenaires qui interagissent, soit un anticorps spécifique à chacune des deux cibles (ou marqueurs) est marqué avec le donneur ou l'accepteur. En excitant le donneur, l'énergie est transférée à l'accepteur, qui émet en raison du transfert d'énergie par résonance de fluorescence, si les cibles sont proches. L'intensité de l'émission est proportionnelle à la quantité de liaison qui a lieu.
Dans la technologie TR-FRET, le fabricant utilise différents fluorophores formant différentes paires.
Les lanthanides sont généralement excités à 320-340 nm. L'émission de l'europium est généralement détectée à 620 nm, tandis que celle du terbium peut l'être à 490 ou 620 nm, selon le kit et le fabricant. Pour les accepteurs, l'émission est soit de 520 nm pour les fluorophores verts, soit de 665 nm pour les fluorophores rouges. L'émission du donneur est utilisée comme référence interne, tandis que l'émission de l'accepteur sert d'indicateur au transfert d'énergie (événement de liaison) qui a lieu (voir la figure 3).
Un délai de l'ordre de la microseconde est appliqué entre l'excitation et la détection de la fluorescence. Cela permet d'éliminer la fluorescence de fond non spécifique de courte durée. L'émission est ensuite généralement détectée sur une période de temps (fenêtre de mesure) de quelques microsecondes (voir la figure 4). Les réglages du délai et de la fenêtre de mesure peuvent varier en fonction du kit et du fabricant.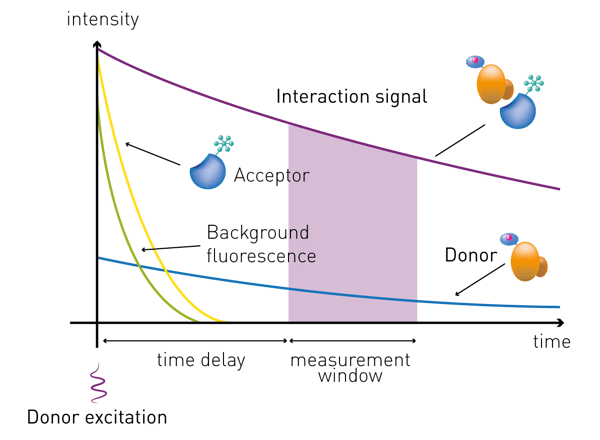
Un rapport des signaux intégrés dans le temps des deux canaux d'émission est ensuite calculé. Cette mesure ratiométrique permet de normaliser le signal, d'éliminer l'interférence du milieu et le quenching, ainsi que de corriger les erreurs de manipulation du liquide ou la variabilité d'un puits à l'autre.
Sa sensibilité et sa polyvalence ont largement contribué à la popularité des essais TR-FRET. La combinaison de la détection résolue en temps et des mesures ratiométriques élargit considérablement la fenêtre d'essai et réduit le bruit de fond. De plus, l'émission des lanthanides est stable dans le temps, ne blanchit pas et est compatible avec différents réactifs et conditions expérimentales.
Malgré ces avantages, le principal atout de cette méthode est probablement le fait que la détection de la paire liée ne nécessite pas de séparer physiquement les composants non liés afin de réduire le bruit de fond. En tant qu'essai dit homogène, le TR-FRET ne nécessite pas d'étapes de lavage intermédiaires et peut être exécuté comme un simple essai « add-and-read » (voir la figure 5), ce qui le rend plus pratique et moins chronophage que les ELISA. Il est donc particulièrement adapté aux campagnes de criblage HTS automatisées.
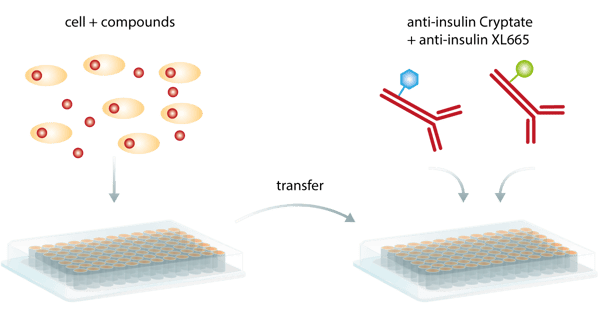
Cependant, l'extinction du signal due à des interactions externes avec le processus d'excitation intramoléculaire ou à la fluorescence des composés de la bibliothèque ou des protéines biologiques peut constituer une limitation.4
Les kits de tests TR-FRET sont disponibles auprès de plusieurs fabricants. Bien que tous les tests soient basés sur une technologie commune et puissent être détectés sur un lecteur de microplaques, il existe des différences entre les kits et les fabricants. Celles-ci sont principalement liées aux différents types de donneurs et d'accepteurs, à leurs combinaisons, ainsi qu'aux moments de début de détection et de mesure.
Toutes les technologies de dosage et leurs caractéristiques, y compris les pics d'excitation et d'émission, sont résumées dans le tableau 1. Outre ces caractéristiques, ces kits varient également en termes de temps d'intervalle et de fenêtres d'essai.
Tableau 1 : comparaison des kits de dosage TR-FRET les plus courants et de leurs pics d'excitation et d'émission
| Kit | Donneur | Type de cage | Excitation | Émission | Accepteur | Émission |
| LANCE | Europium | Chélate | 320 nm | 620 nm | ULightTM | 665 nm |
| LANCE | Europium | Chélate | 320 nm | 620 nm | Surelight® APC | 665 nm |
| LanthaScreen Eu | Europium | Chélate | 320 nm | 620 nm | AlexaFluor 647 | 665 nm |
| LanthaScreen Tb | Terbium | Chélate | 340 nm | 490 nm | Fluorescéine/GFP | 520 nm |
| HTRF rouge (Eu) | Europium | Cryptate | 320 nm | 620 nm | XL665/d2 | 665 nm |
| HTRF rouge (Tb) | Terbium | Cryptate | 340 nm | 620 nm | XL665/d2 | 665 nm |
| HTRF vert (Tb) | Terbium | Cryptate | 340 nm | 620 nm | Fluorescéine/GFP | 520 nm |
| Transcreener TR-FRET | Terbium | Chélate | 340 nm | 620 nm | HiLyte647 | 665 nm |
| THUNDER | Europium | Chélate | 320 nm | 620 nm | Colorant rouge lointain | 665 nm |
Outre l'utilisation de kits disponibles dans le commerce, il est également possible de combiner librement des paires de donneurs et d'accepteurs TR-FRET, à condition que le spectre d'émission du donneur présente un chevauchement suffisant avec le spectre d'excitation de l'accepteur, comme le montre l'AN 388 : Liaison différentielle des dérivés du ∆9-tétrahydrocannabinol aux récepteurs cannabinoïdes de type 1 (CB1).
La détection FRET résolue en temps est principalement réalisée sur des lecteurs de microplaques. La configuration de base d'un tel lecteur comprend une source lumineuse, des filtres d'excitation et d'émission permettant de sélectionner la longueur d'onde, ainsi qu'un détecteur à tube photomultiplicateur (PMT). Outre le mode de détection TRF, les lecteurs de microplaques doivent pouvoir mesurer deux canaux d'émission en une seule fois, de manière séquentielle ou simultanée. Le TR-FRET étant principalement utilisé pour le criblage à haut débit, la compatibilité avec les microplaques de 384 et 1536 puits est généralement obligatoire.
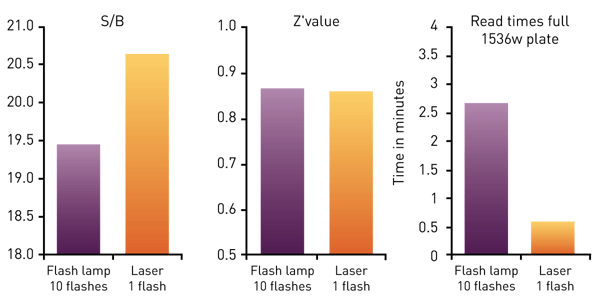
Les complexes de chélates ou de cryptates sont généralement excités à une longueur d'onde de 320 à 340 nm. Une lampe flash au xénon ou un laser d'excitation spécifique peuvent donc être utilisés comme source lumineuse. Un laser TRF concentre davantage d'énergie sur cette plage de longueurs d'onde spécifique et offre une meilleure discrimination entre les signaux faibles et élevés.
Le PHERAstar FSX est équipé d'un laser TRF dont la fréquence de flash est de 60 Hz, ce qui offre un avantage significatif en termes de vitesse pour la détection TR-FRET. Il permet de mesurer une microplaque complète de 1536 puits en 36 secondes, tout en conservant un Z' > 0,8 pour les essais cellulaires et biochimiques (voir la publication : « Cellular and biochemical HTRF assays measured in 1536-well microplates »), comme le montre la figure 7.
Dans la publication : « Excellent assay performance of THUNDER™ TR-FRET cell-based cytokine assays performed on the PHERAstar FSX », il est démontré que le PHERAstar FSX avec laser TRF présente une sensibilité et une plage dynamique beaucoup plus élevées qu'un lecteur de microplaques HTS concurrent.
 Les détecteurs dédiés
Les détecteurs dédiésLe PHERAstar FSX est équipé de détecteurs à comptage de photons (PMT) pour la détection du TR-FRET. Les détecteurs ordinaires fournissent une valeur d'intégration de l'aire sous la courbe pendant le temps d'intégration. Les PMT à comptage de photons comptent chaque photon individuellement et surveillent ainsi l'ensemble de la courbe de désintégration du lanthanide.
Sur le lecteur PHERAstar FSX, la détection par comptage de photons permet de mesurer et d'afficher la courbe de décroissance de l'émission avec une résolution temporelle de 2 microsecondes. Cette fonction unique, appelée Decay Curve Monitoring, simplifie le développement des essais et permet d'optimiser les paramètres de synchronisation, d'améliorer la détection et de réduire le bruit de fond. Associée à l'assistant d'intégration, la surveillance de la courbe de décroissance offre une plateforme pour l'optimisation des essais TR-FRET.
La détection des deux longueurs d'onde d'émission est nécessaire, soit séquentiellement, soit simultanément. En règle générale, les lecteurs de microplaques mesurent les deux émissions l'une après l'autre. La détection simultanée présente toutefois plusieurs avantages.
Le système de détection à double émission simultanée (SDE) du PHERAstar FSX utilise deux photomultiplicateurs (PMT) appariés pour effectuer des mesures parallèles des deux longueurs d'onde d'émission. Le SDE réduit ainsi de moitié les temps de lecture et augmente le débit, tout en corrigeant les variations causées par les différences de volume de remplissage, de concentration ou d'énergie d'excitation. Ces caractéristiques permettent d'améliorer la sensibilité et de réduire le %CV. Les mesures SDE à canal unique sont combinées pour effectuer le calcul ratiométrique des résultats des deux canaux d'émission.
Dans le cadre du criblage de médicaments, la réduction de l'échelle des essais est une étape essentielle. La miniaturisation permet de réduire les volumes d'échantillons tout en garantissant la reproductibilité, la fiabilité et la robustesse des essais. Les essais peuvent être réduits à des microplaques de 3456 puits, mais les formats 384 et 1536 puits sont les plus courants.
Les essais TR-FRET peuvent être miniaturisés tout en conservant leur précision et leur reproductibilité, car l'intensité du signal dépend de la concentration du traceur et non de sa quantité. L'utilisation d'un lecteur de microplaques très sensible, comme le PHERAstar FSX, renforce cette affirmation.
Dans l'exposé scientifique : « Successfully downscaling screening assays : L'expérience de Servier », nous présentons une étude de cas dans laquelle le lecteur de microplaques PHERAstar FSX a contribué de manière significative à la miniaturisation d'un essai HTRF, passant du format 384 au format 1536 puits. Sur le PHERAstar FSX, la miniaturisation a été combinée à une nouvelle dilution des réactifs et à une détection « à la volée » (un seul flash par puits). Il en résulte des valeurs Z' de haute qualité et une réduction significative de l'utilisation de réactifs et du temps de traitement.

Le TR-FRET est utilisé pour analyser les événements de liaison dans les essais biochimiques. Il est également adapté aux essais cellulaires, car les mesures des lysats cellulaires peuvent être effectuées en présence d'un milieu de culture (détection homogène).
Les différents paramètres biologiques analysés comprennent les interactions protéine-ADN/ARN, la liaison protéine-protéine (ligand-récepteur), les kinases et les voies de signalisation, y compris les RCPG, les cytokines et les biomarqueurs.
Cette technique est particulièrement populaire dans le domaine du criblage de médicaments, car elle présente une grande sensibilité, un débit élevé, une grande fiabilité et une grande flexibilité, et permet d'obtenir un nombre réduit de résultats faussement positifs ou faussement négatifs.
Les interactions moléculaires entre les protéines et entre les protéines et les acides nucléiques ont lieu à tous les niveaux de la cellule. Elles comprennent l'épigénétique (par exemple, l'activité de modification des histones, qui peut être utilisée pour étudier l'inhibition des histones désacétylases), la transduction des signaux (par exemple, l'activation des protéines G), la communication cellulaire (par exemple, l'interaction ligand-récepteur), la régulation des gènes, etc. Les interactions protéine-protéine jouent également un rôle crucial dans le fonctionnement des PROteolysis TArgeting Chimeras (PROTACs ) ou des colles moléculaires, de petites molécules qui ciblent sélectivement les protéines indésirables pour les diriger vers le système d'élimination des protéines de la cellule (système ubiquitine-protéasome). Les chercheurs ont le choix entre différentes options pour tester la tester la dégradation des protéines sur des cellules. Pour la dégradation ciblée des protéines par les PROTAC et les colles moléculaires, des techniques telles qu'AlphaScreen®, le transfert d'énergie par résonance de fluorescence résolue en temps (TR-FRET) ou des méthodes de luminescence comme NanoBRET™ peuvent être utilisées dans des microplaques pour mesurer l'interaction entre la cible et la ligase. Ces techniques peuvent également être utilisées pour étudier la dégradation ciblée des protéines résultant d'interactions spécifiques entre des dégrons et des ligases connus.
Dans ce témoignage, Nick Bland de la société Domainex, explique comment le PHERAstar FSX soutient ses recherches biochimiques, avec des valeurs Z' de 0,9 lors de campagnes HTS basées sur le TR-FRET.

L'activité kinase est principalement analysée à l'aide de tests en sandwich mesurant le changement de phosphorylation d'un substrat, comme le montre la publication : « Analyse de la phosphorylation de ERK1/2, p38αβγ, et STAT3 avec les immunodosages de kinases cellulaires THUNDER™ TR-FRET ». Des tests de compétition peuvent également être utilisés pour contrôler les différents produits générés par la réaction (par exemple, l'ADP). On peut également utiliser un substrat de kinase marqué de façon fluorescente et un anticorps anti-phospho marqué au lanthanide (voir la figure 8), comme indiqué dans la publication : « LanthaScreen TR-FRET tyrosine kinase and protein kinase C assay" (Essai tyrosine kinase et protéine kinase C LanthaScreen TR-FRET) ». Ces méthodes peuvent également être appliquées aux protéases et à l'ubiquitination. Pour plus d'informations sur la détection de l'activité kinase, consultez notre article de blog : « Kinase assays ».
Les essais visant à étudier les récepteurs couplés aux protéines G (RCPG) peuvent être de nature mécanistique ou fonctionnelle. Les essais fonctionnels se concentrent principalement sur la quantification des seconds messagers (par exemple l'IP1 ou l'AMPc), car ceux-ci peuvent s'accumuler dans la cellule en raison de l'activité d'inhibiteurs spécifiques. Ces messagers sont donc utilisés comme indicateurs, car leur concentration est en corrélation avec la liaison du ligand et l'activation du récepteur. Ceci est illustré dans les publications : « HTRF IP-One assay used for functional screening ». et « GPCR activation is measured using Cisbio's cAMP and IP1 HTRF HTplex cell-based assay ». Les tests mécanistes se concentrent sur l'organisation et l'oligomérisation des récepteurs sur la membrane cellulaire afin d'assurer la médiation de la signalisation.
L'analyse des produits de signalisation en aval permet d'identifier les voies aberrantes qui pourraient jouer un rôle dans les maladies neurologiques, métaboliques et inflammatoires. Le FRET résolue en temps permet de tester l'efficacité des composés ciblant spécifiquement ces maladies. Parmi les exemples d'application, citons le « développement d'un test rapide d'insuline par HTRF » pour les maladies métaboliques, en particulier le diabète sucré, la « détection de l'agrégation de la protéine tau humaine » dans les maladies neurodégénératives ainsi que les excellentes performances des tests de cytokines THUNDER™ TR-FRET sur cellules, réalisés sur le PHERAstar FSX pour la quantification des cytokines dans différentes maladies.
Dans l'exposé scientifique intitulé : « Targeting the type 1 cholecystokinin receptor to screen for novel obesity treatments », il est expliqué comment un essai TR-FRET a été utilisé pour détecter l'accumulation d'inositol monophosphate, un métabolite en aval de l'IP3. Sur la base de ces résultats, un autre essai de liaison basé sur la TR-FRET a été développé.

En raison de difficultés techniques et d'un débit relativement faible, l'étude de la cinétique de la liaison ligand-récepteur a traditionnellement été menée à un stade tardif de la découverte de médicaments. Cependant, l'optimisation de ces paramètres aurait un impact positif sur l'efficacité, l'apparition d'effets secondaires, ainsi que sur l'efficacité et la durée d'action, ce qui bénéficierait grandement à la découverte de médicaments. De plus, la cinétique de liaison semble jouer un rôle dans l'agonisme biaisé. Il est donc souhaitable d'examiner la cinétique de liaison des candidats médicaments à un stade précoce, avant de passer aux modèles in vivo et aux études cliniques.
Les études cinétiques de liaison peuvent être réalisées efficacement sur des lecteurs de microplaques permettant la détection cinétique TR-FRET pour le criblage et l'étude cinétique de composés à faible affinité, comme indiqué dans l'exposé scientifique : « A TR-FRET approach to measure the kinetics of ligand-receptor binding and its application of fragment screening (Une approche TR-FRET pour mesurer la cinétique de liaison ligand-récepteur et son application au criblage de fragments) » et dans la publication : « Analyze binding kinetics with HTRF" (Analyser la cinétique de liaison avec la HTRF) ».

Ses caractéristiques uniques dédiées aux études cinétiques de liaison font du PHERAstar FSX le lecteur de microplaques le plus performant du marché. Grâce à sa haute résolution temporelle dans la détection TR-FRET et à ses solutions matérielles/logicielles dédiées, il peut facilement résoudre les événements de liaison et calculer les taux Kon et Koff.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows