
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Aumenta la sensibilità del test con la fluorescenza risolta nel tempo, riducendo il rumore di fondo per accurate analisi immunologiche e studi di interazione.
La fluorescenza è l'emissione di luce da parte di una molecola in seguito all'eccitazione di una luce di lunghezza d'onda inferiore a quella emessa.
La rilevazione della fluorescenza può essere suddivisa principalmente in due tipi di misurazioni: la fluorescenza allo stato stazionario e quella risolta nel tempo. La differenza principale tra questi due metodi si basa sulla natura e sulle proprietà delle molecole fluorescenti (fluorofori) utilizzate e sul conseguente tempo di rilevazione.
Lo stato stazionario è la modalità di rilevazione fluorescente più diffusa e viene comunemente definita "intensità di fluorescenza". I fluorofori standard (ad es. fluoresceina, rodamina, ecc.) emettono luce a una lunghezza d'onda specifica entro nanosecondi dall'eccitazione. Questo brevissimo intervallo di tempo tra l'eccitazione e l'emissione consente la rilevazione quasi concomitante del segnale di emissione fluorescente con l'eccitazione del campione.
Il secondo tipo, la fluorescenza risolta nel tempo (TRF), viene monitorata in funzione del tempo al momento dell'eccitazione. A differenza dell'intensità di fluorescenza allo stato stazionario, la fluorescenza risolta nel tempo si basa sul rilevamento dei decadimenti dell'intensità e/o sul rilevamento ritardato del segnale di emissione all'eccitazione. Nelle misure di fluorescenza risolta nel tempo, l'impulso di luce di eccitazione è più breve del tempo di decadimento del segnale fluorescente. La rilevazione della fluorescenza risolta nel tempo può essere ottenuta solo quando il segnale di emissione del fluoroforo è prolungato fino al micro o addirittura al milli-secondo e non ha una vita breve nell'arco di nanosecondi come nel caso delle etichette comuni (fig.1).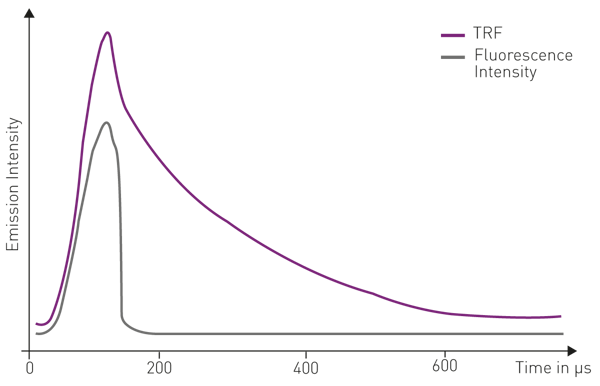
I lantanoidi (Ln) sono un gruppo di elementi chimici metallici unicamente fluorescenti, spesso noti collettivamente come "elementi delle terre rare". I lantanoidi hanno coefficienti di assorbimento (eccitazione) molto bassi e tassi di emissione lenti. Ciò si traduce in tempi di decadimento della fluorescenza prolungati, compresi tra 0,5 e 3 millisecondi (lunghi tempi di vita). Tutti gli elementi lantanidi formano cationi trivalenti (Ln3+) e mostrano emissione in soluzione acquosa. Inoltre, i loro picchi di emissione sono molto netti e stretti con un grande spostamento Stokes.[1]
I lantanidi possiedono proprietà favorevoli come sonde biochimiche. Originariamente, sono stati impiegati nei sistemi biologici come sonde luminescenti per il calcio. Infatti, è stato dimostrato che la luminescenza dei lantanidi è un sensore sensibile per i siti di legame del Ca2+ nelle proteine.[2]
Il loro prolungato decadimento della fluorescenza li rende fluorofori ideali per applicazioni di fluorescenza risolta nel tempo. Quattro di essi, l'europio, il terbio, il samario e il disprosio, hanno trovato largo impiego nelle scienze biologiche, in particolare nei test immunologici a fluorescenza risolta nel tempo; l'europio e il terbio sono i più utilizzati (fig. 2).
Gli ioni europio (Eu3+), in particolare, sono spesso utilizzati come etichette per la rilevazione della fluorescenza risolta nel tempo nei test immunologici. Oltre alla fluorescenza a lunga emissione, l'europio mostra un ampio spostamento Stokes (290 nm) senza sovrapposizione tra lo spettro di eccitazione e quello di emissione e, con una larghezza di banda di soli 10 nm, uno spettro di emissione molto netto a 615 nm (fig. 3).[3]
Poiché l'emissione dei lantanidi è di solito troppo debole per le applicazioni di fluorescenza risolta nel tempo, in genere non vengono eccitati direttamente, ma vengono inseriti in una sorta di "gabbia" che raccoglie la luce. Questa gabbia, più comunemente un chelato o un criptoato, consente sia la raccolta di energia che il trasferimento di energia agli ioni lantanoidi, con conseguente aumento dell'intensità di emissione (fig. 4). È bene ricordare che lo spettro di eccitazione del complesso gabbia-lantanide riflette lo spettro di assorbimento della "gabbia" e non del lantanide stesso.[4]
Oltre a un segnale di emissione più elevato, la chelazione rende possibile la coniugazione dello ione lantanoide con componenti biologici (ad esempio anticorpi, recettori, ligandi, ecc.), un requisito obbligatorio per diverse applicazioni di fluorescenza risolta nel tempo.![Fig. 4: esempio di complesso chelato di Europio in stato fluorescente. Modificato da [5].](https://www.bmglabtech.com/hs-fs/hubfs/Webseite/5_Resources/ABC/Detection%20Modes/time-resolved-fluorescence-fig4.webp?width=600&name=time-resolved-fluorescence-fig4.webp)
Come per il rilevamento dell'intensità della fluorescenza, il setup per le misurazioni della fluorescenza risolta nel tempo consiste in una sorgente luminosa, un dispositivo ottico per la selezione della lunghezza d'onda e un rivelatore a tubo fotomoltiplicatore (PMT).
Poiché il complesso lantanide-chelato/criptato è tipicamente eccitato a 337 nm, come sorgente luminosa per la rilevazione della fluorescenza risolta nel tempo si utilizza una lampada flash allo xeno o un laser specifico. I lettori di piastre multimodali sono dotati di una lampada flash allo xeno a banda larga, in quanto offre una maggiore flessibilità per più metodi di rilevazione. I lettori di fascia alta possono offrire in aggiunta un laser opzionale dedicato all'eccitazione della fluorescenza risolta nel tempo. Il laser concentra una maggiore energia sulle specifiche lunghezze d'onda di eccitazione dei lantanidi e potrebbe portare a risultati migliori con una migliore discriminazione tra segnali bassi e alti. Tuttavia, data la forte eccitazione a circa 337 nm, si tratta di una sorgente di luce monouso che non può essere utilizzata come sorgente di eccitazione per altri metodi di rilevamento, tranne la fluorescenza risolta nel tempo.
Per quanto riguarda la selezione delle lunghezze d'onda, per la rilevazione di saggi di fluorescenza risolti nel tempo si possono utilizzare sia lettori di piastre a filtro che monocromatori. Poiché i lettori a filtro sono solitamente più sensibili dei monocromatori grazie alla maggiore trasmissione della luce, sono consigliati per i dosaggi TRF con una resa fotonica limitata. In genere, i dosaggi di trasferimento di energia di fluorescenza risolti nel tempo sono particolarmente impegnativi per i lettori basati su monocromatori.
I tubi fotomoltiplicatori (PMT) sono utilizzati come rivelatori. A causa delle proprietà di lunga emissione dei lantanidi, nella fluorescenza risolta nel tempo, il rivelatore PMT viene acceso dopo che si è verificata l'eccitazione. Ciò consente al segnale autofluorescente a vita breve di svanire. L'intensità del segnale di emissione viene quindi integrata in funzione del tempo per una specifica finestra temporale. Questi due parametri sono denominati "inizio integrazione" e "tempo di integrazione" e di solito sono dell'ordine dei microsecondi (fig. 5).
I lettori di micropiastre di fascia alta possono anche essere dotati dei cosiddetti PMT a conteggio di fotoni per la fluorescenza risolta nel tempo. Mentre normalmente i lettori di micropiastre forniscono semplicemente un valore di integrazione per l'area sotto la curva durante il tempo di integrazione, il rilevamento della fluorescenza risolta nel tempo con conteggio dei fotoni monitora l'intera curva di decadimento del lantanoide.
Sul lettore PHERAstar FSX, il rilevamento del conteggio dei fotoni consente di misurare e visualizzare la curva di decadimento dell'emissione con una risoluzione temporale di 2 microsecondi. Questa caratteristica unica, chiamata monitoraggio della curva di decadimento, semplifica lo sviluppo di saggi di fluorescenza risolti nel tempo, aiutando a ottimizzare i parametri di temporizzazione e migliorando così la rilevazione del segnale e riducendo il rumore di fondo.
I test immunologici basati sulla fluorescenza risolta nel tempo sono utilizzati per quantificare molecole specifiche come proteine o citochine. Si basano sul riconoscimento e sul legame del bersaglio da parte di anticorpi specifici marcati con un fluoroforo. L'analisi e la quantificazione del segnale fluorescente forniscono indirettamente informazioni sulle molecole bersaglio. I test immunologici sono quantitativi, altamente sensibili e offrono la possibilità di un rilevamento multiparametrico (multiplexing).
Simili ai classici saggi ELISA, i saggi immunologici a fluorescenza risolti nel tempo utilizzano comunemente un anticorpo di cattura legato al fondo del pozzetto della micropiastra. Quando i campioni vengono incubati in questi pozzetti, l'anticorpo cattura la molecola target sulla piastra. Dopo la rimozione del campione non legato mediante lavaggio della piastra, viene aggiunto un secondo anticorpo legato covalentemente a un chelato di lantanide, più comunemente l'europio. Questo lega la molecola bersaglio mentre il secondo anticorpo non legato viene lavato via. La quantità di anticorpo marcato con il lantanide è proporzionale alla concentrazione della molecola bersaglio nel campione. I test immunologici a fluorescenza risolti nel tempo possono essere eseguiti come test diretti o competitivi.
Per liberare le molecole di europio dalla loro "gabbia" sull'anticorpo è necessaria una fase di potenziamento dissociativo per tre motivi: in primo luogo, i lantanidi hanno uno scarso assorbimento della luce; in secondo luogo, raramente vengono eccitati direttamente; in terzo luogo, i chelati di lantanide sono scarsamente fluorescenti solo se coniugati a componenti biologici (in questo caso gli anticorpi). La dissociazione è promossa dall'aggiunta di una soluzione specifica, comunemente chiamata "soluzione di potenziamento". Oltre a dissociare il lantanide, la soluzione promuove la formazione di una nuova "gabbia" chelata che incorpora il cromoforo necessario per l'eccitazione del lantanide. Il chelante-cromoforo nella soluzione potenziante viene utilizzato per assorbire e trasferire la luce di eccitazione al lantanide, aumentando significativamente l'intensità del segnale di emissione (fig. 6).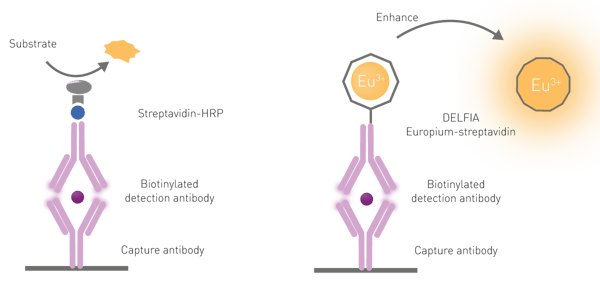
I campioni vengono eccitati da un impulso di luce a una lunghezza d'onda specifica, di solito 337 nm. La rilevazione è temporizzata in base al decadimento del segnale di autofluorescenza. Ciò significa che la rilevazione della fluorescenza risolta nel tempo inizia solo dopo l'esaurimento del segnale di autofluorescenza a vita breve (microsecondi). Il segnale di emissione rilevato viene integrato per una specifica finestra temporale e i dati vengono misurati come intensità integrata, non come decadimento temporale. Poiché la quantità di analita è proporzionale al segnale di emissione risolto nel tempo, può essere facilmente quantificata con l'uso di una curva standard.
Uno degli immunodosaggi a fluorescenza risolti nel tempo più comunemente utilizzati è DELFIA®.
Il DELFIA (Dissociation-Enhanced Lanthanide Fluorescent Immunoassay) è un test eterogeneo a fluorescenza risolta nel tempo basato su lavaggi e sviluppato su un principio e un flusso di lavoro simili a quelli degli ELISA. Si dice che superi le limitazioni tipiche dei test ELISA, fornendo un intervallo dinamico più ampio e segnali stabili che possono essere misurati fino a mesi dopo l'esecuzione del test. Per il rilevamento DELFIA, i lettori di piastre devono essere dotati di un rilevatore di fluorescenza a risoluzione temporale con eccitazione a 337 nm ed emissione a 615 nm.
Nei dosaggi DELFIA, gli anticorpi di cattura sono legati alla micropiastra. Dopo l'aggiunta del campione e una serie di lavaggi per eliminare il campione non legato, viene aggiunto un anticorpo di rilevazione marcato con europio. Infine, dopo un'ultima serie di lavaggi, viene aggiunta una soluzione di potenziamento. Come già menzionato, i dosaggi DELFIA richiedono una fase di potenziamento dissociativo per produrre un segnale fluorescente. Questa dissociazione promuove la formazione di un nuovo chelato altamente fluorescente in una soluzione micellare stabile. Un esempio di immunodosaggio DELFIA è illustrato nella nota applicativa "Time-Resolved Fluorescence (TRF) immunoassay in 384-well format using a matched antibody pair kit and the PHERAstar FSX".
Sebbene robusti e molto sensibili, i dosaggi DELFIA non sono adatti per lo screening ad alta produttività, poiché la procedura prevede fasi di legame, incubazione e lavaggio.
Gli esosomi sono vescicole extracellulari di origine endosomiale, contenenti acidi nucleici, proteine e lipidi. Facilitano la comunicazione intercellulare tra diversi tipi di cellule all'interno di un organismo. I kit di rilevamento degli esosomi a fluorescenza risolta nel tempo TRIFic™ rilevano la presenza di esosomi in base all'espressione di specifiche proteine di membrana.
Sono disponibili sonde fluorescenti specifiche sensibili all'ossigeno e al pH per l'analisi dei parametri metabolici cellulari in modalità di fluorescenza risolta nel tempo. In note applicative specifiche, mostriamo come il consumo di ossigeno intracellulare ed extracellulare e l'attività glicolitica possano essere determinati in tempo reale in cellule viventi.
Probabilmente, l'altra applicazione più diffusa della fluorescenza risolta nel tempo è la TR-FRET ( time-resolved fluorescence energy transfer). Il suo uso principale si trova nelle applicazioni di screening di farmaci e ad alto rendimento, poiché i saggi di trasferimento di energia di fluorescenza risolti nel tempo sono robusti e facili da automatizzare e miniaturizzare. La loro applicazione principale è lo studio dell'interazione proteina-proteina o ligando-recettore.
L'autofluorescenza è emessa da tutti i campioni biologici e di solito è un fattore limitante per la sensibilità del saggio. Poiché decade in nanosecondi, le misure di fluorescenza risolta nel tempo (time-gated) nell'intervallo dei micro o milli secondi consentono di rilevare il segnale di emissione dei lantanidi una volta esaurito il segnale di autofluorescenza. Il rumore fluorescente "a vita breve" (segnali di fondo e luce di eccitazione diffusa) viene eliminato e i segnali di fluorescenza risolti nel tempo (a vita lunga) possono essere misurati con una sensibilità molto elevata, in quanto l'unico segnale di fondo è costituito dall'etichetta non legata in modo specifico. Questo riduce il rumore di fondo e aumenta la sensibilità rispetto alla rilevazione dell'intensità di fluorescenza allo stato stazionario.
La differenza tra i massimi delle lunghezze d'onda di eccitazione e di emissione (picchi) è definita come spostamento di Stokes. Per molti fluorofori allo stato stazionario disponibili in commercio, questo spostamento è relativamente stretto e comporta l'auto-quenching del segnale a causa della sovrapposizione tra gli spettri di assorbimento e di emissione. Al contrario, i lantanoidi presentano ampi spostamenti di Stokes, aumentando notevolmente il rapporto segnale-sfondo (S/B) nella rilevazione della fluorescenza risolta nel tempo.
I lantanoidi hanno un'elevata resa quantica e una maggiore intensità di fluorescenza rispetto ai "normali" fluorofori. Questo migliora significativamente la sensibilità del test nella fluorescenza risolta nel tempo. L'elevata resa quantica rende i lantanoidi perfettamente adatti come donatori ma non come accettori.
Se i test immunologici a fluorescenza risolta nel tempo vengono interrotti prima della fase di dissociazione/enhancement e conservati correttamente, secondo i produttori sono stabili fino a 10 anni. L'unico passaggio necessario per rianimarli è l'aggiunta della soluzione di potenziamento.
Come discusso in precedenza, i chelati di solito incorporano i lantanidi in "gabbie" che hanno la funzione di stabilizzare, legare il fluoroforo a una molecola o potenziarne le proprietà fluorescenti. Nella rilevazione della fluorescenza risolta nel tempo, quest'ultimo passaggio è necessario per aumentare le intensità di emissione che sarebbero piuttosto scarse se i lantanoidi fossero allo stato "naturale". Il passaggio tra questi diversi tipi di gabbie presenta tuttavia una limitazione significativa, in quanto sono necessari più passaggi intermedi come il lavaggio o l'aggiunta di soluzioni. Questo non è solitamente il caso dei saggi basati sull'intensità della fluorescenza.
Sebbene sia più sensibile ed efficiente, la rilevazione a fluorescenza risolta nel tempo richiede una spesa maggiore per i reagenti e la strumentazione, rispetto ai metodi basati sull'intensità della fluorescenza.
I saggi di fluorescenza risolta nel tempo richiedono di solito la rilevazione dall'alto del pozzetto e sono generalmente eseguiti in piastre bianche. Poiché la rilevazione ritardata nel tempo elimina l'autofluorescenza e riduce lo sfondo, le piastre bianche sono vantaggiose. Esse riflettono e migliorano l'emissione di luce, fornendo segnali più forti. Le piastre nere sono consigliate nel caso in cui un segnale forte possa saturare il rivelatore.
Per i saggi cellulari a fluorescenza risolta nel tempo, si raccomanda la rilevazione dal fondo di una piastra con pareti bianche/nere e fondo trasparente. Tuttavia, poiché non tutti i fondi trasparenti sono trasparenti ai raggi UV, la plastica può assorbire la luce a 340 nm e quindi ridurre significativamente la luce di eccitazione (in genere a 337 nm). Prima di eseguire il saggio di fluorescenza risolta nel tempo, è consigliabile controllare le specifiche della micropiastra e utilizzare piastre con un fondo trasparente ai raggi UV. Per maggiori dettagli, leggere il nostro post sul blog"La micropiastra: utilità nella pratica".
Come discusso in precedenza, la rivelazione risolta nel tempo elimina l'autofluorescenza. Tuttavia, le fasi di lavaggio dopo l'incubazione con i reagenti marcati con lantanidi e prima dell'aggiunta della soluzione di potenziamento sono piuttosto critiche e possono influire sulla qualità del test. Queste fasi devono essere molto efficienti per rimuovere tutti i reagenti marcati non legati. In caso contrario, il saggio produrrà un elevato segnale di fondo causato dalla presenza di ioni lantanidi non legati in modo specifico.
Per i dosaggi DELFIA, i tamponi a base di tris-HCl dovrebbero essere preferiti a quelli a base di fosfati. Da un lato, alte concentrazioni di fosfati possono potenzialmente dissociare l'europio dal suo chelato durante i lunghi tempi di incubazione. Dall'altro, il segnale massimo è generalmente inferiore con i tamponi a base di fosfati rispetto a quelli a base di tris-HCl.
Un pH basso può potenzialmente liberare lo ione lantanide dal suo chelato. Ciò può influire negativamente sull'integrità del colorante e aumentare il legame non specifico e lo sfondo nella rilevazione della fluorescenza risolta nel tempo. Inoltre, occorre prestare attenzione alla presenza di EDTA nei reagenti, poiché può inattivare i chelati di lantanide.
Poiché i lantanidi non hanno un'emissione di luce polarizzata, non possono essere utilizzati per misurare l 'anisotropia e la polarizzazione della fluorescenza.[5]
DELFIA è un marchio registrato di Perkin Elmer, Inc.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series