
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Mikrotiterplatten gibt es in verschiedenen Farben, Materialien, Well-Dichten und Geometrien. Finden Sie heraus, welches Format für Ihre Anwendungen am besten geeignet ist.
Mikroplatten zählen im Labor als Verbrauchsmaterial und bestehen aus einer Platte mit mehreren Vertiefungen (Wells), die als kleine Probengefäße verwendet werden. Sie werden auch als Mikrotiterplatten oder Multiwellplatten bezeichnet und sind in der Regel in den Formaten 6-, 12-, 24-, 48-, 96-, 384- oder 1536-Well erhältlich, wobei das 96-Well-Layout das am häufigsten verwendete ist. Je nach Größe der Vertiefungen können sie Mikroliter- bis Millilitermengen an Probe aufnehmen.
Mikrotiterplatten erleichtern die Vorbereitung, Handhabung, Untersuchung, Verarbeitung und Organisation vieler Proben. Sie sind heute ein Standard in der biowissenschaftlichen und pharmazeutischen Forschung sowie in der klinischen Diagnostik und analytischen Forschung. Enzyme-linked immunosorbent assays (ELISA) sind eine der am häufigsten verwendeten Anwendungen. Die Einsatzmöglichkeiten sind jedoch vielfältig und in den Biowissenschaften weit verbreitet. Sie umfassen die Lagerung, Filtration, Trennung und Mischung von Proben sowie ihren Nachweis und ihre Quantifizierung.

Mikrotiterplatten wurden 1951 von dem ungarischen Mikrobiologen Dr. Gyula Takátsy (Abb. 1) entwickelt, als eine Grippeepidemie zu einem Mangel an Laborausrüstung führte. Takátsy musste eine kostengünstige Lösung finden, um seine klinischen Tests durchführen zu können. Er stellte fest, dass Tests in großen Chargen zu teuer waren und dass sich der Durchsatz erheblich steigern ließ, wenn man mehrere Proben nebeneinander anordnete. So stellte er die erste Mikroplatte her, indem er 8 Reihen von 12 Wells (8*12 = 96) von Hand zusammensetzte und mit einer Drahtschlaufe verband. Diese Lösung ermöglichte es ihm, beim Pipettieren Zeit zu sparen.
In den 1960er Jahren gewann seine Erfindung allmählich an Popularität und wurde von Laboren auf der ganzen Welt als Standardausrüstung für biomedizinische Tests übernommen.
Durch die Einführung einer gegossenen Version in den späten 1980er Jahren wurde die breite Anwendung weiter erleichtert. Dadurch wurde der Preis pro Einheit gesenkt und die Produktionskapazität erhöht. In den folgenden Jahren wurden die Mikroplatten weiter verbessert und mehrere Varianten entwickelt, um den unterschiedlichen Anforderungen der wissenschaftlichen Gemeinschaft gerecht zu werden.
In den 1990er Jahren bemühte sich die 'Society for Biomolecular Screening' (SBS) um eine Standardisierung der Merkmale und Formen. Zu den Merkmalen gehörten vor allem die Anzahl, Form und Größe der Wells sowie Eigenschaften wie die allgemeinen Abmessungen und das Material. Im Jahr 2003 schlug das 'American National Standards Institute' (ANSI) eine Reihe von standardisierten Merkmalen vor und veröffentlichte sie, darunter Durchmesser, Tiefe und Abstand der Wells sowie allgemeine Abmessungen (z. B. 127,76 mm × 85,48 mm).1
Die Standardisierung führte zu einer breiteren Verwendung, die insbesondere der Automatisierung im Labor und der Herstellung von Laborgeräten zugute kam. Infolgedessen wurde die Mikroplatte als effektives Hilfsmittel für die Entwicklung neuer Arzneimittel und die biowissenschaftliche Forschung immer beliebter. Schätzungen zufolge wurden allein im Jahr 2000 rund 125.000.000 Stück verwendet.2
Im Jahr 2010 schlossen sich die SBS und die 'Association for Laboratory Automation' (ALA) zur 'Society for Laboratory Automation and Screening' (SLAS) zusammen. Seitdem werden die Normen für Mikroplatten als ANSI/SLAS bezeichnet.
Eine Vielzahl von Auswahlmöglichkeiten
Abgesehen von der Anzahl der Wells gibt es Mikroplatten in verschiedenen Materialien und Farben sowie mit unterschiedlichen Formen und Volumenkapazitäten. Bei der Vielzahl der Möglichkeiten ist es manchmal schwierig, die optimale Platte für einen bestimmten Test auszuwählen. Im Folgenden werde ich versuchen, die wichtigsten Merkmale zusammenzufassen, wobei der Schwerpunkt auf der spektrophotometrischen Anwendung liegt.
Obwohl es bei den verschiedenen Typen von Mikrotiterplatten unterschiedlicher Hersteller kleine Unterschiede in Bezug auf die Größe und die Position der Wells gibt, haben alle Mikrotiterplatten die gleichen Grundflächenabmessungen. Die Wells sind in der Regel in einer rechteckigen Matrix angeordnet und werden klassischerweise in den Formaten mit 6, 12, 24, 48, 96, 384 und 1536 Wells angeboten (Abb. 2). Ein 3456-Well-Layout ist ebenfalls erhältlich, wird aber nicht so häufig verwendet.
Das Füllvolumen für jedes Well hängt von der Well-Dichte ab. Das am häufigsten verwendete Layout ist das 96-Well-Format (bis zu 300 µL/Well). Layouts mit höheren Dichten werden in der Regel aus Gründen der Miniaturisierung verwendet. 384- (bis zu 100 µL/Well), 1536- (bis zu 15 µL/Well) und sogar 3456-Well Formate (bis zu 5 µL/Vertiefung) fassen nicht nur mehr Proben, sondern reduzieren auch das benötigte Volumen an Reagenzien und damit die Kosten (Tabelle 1).
Als allgemeine Regel gilt, dass ein Drittel des maximalen Füllvolumens das niedrigste empfohlene Volumen für ein Well ist, um eine effiziente und verlässliche Messung zu erhalten. Bei einer Standard-Mikrotiterplatte mit 96 Wells sollten Sie daher 100 µL nicht unterschreiten.
Half-area 96-Well-Mikrotiterplatten (bis zu 170 µL/Vertiefung) sind Zwischenlösungen. Diese haben im Wesentlichen die gleiche Well-Größe wie die 384-Well-Anordnung, wobei die äußeren Abmessungen und Well-Positionen einer 96-Well beibehalten werden. Dementsprechend sind die Wells kleiner und ermöglichen eine Reduzierung des Probenvolumens um bis zu 50 %. Dieses Format wird in der Regel als Alternative zum 384-Well-Format verwendet, wenn geringe Volumina benötigt werden, Automatisierung und Durchsatz aber nicht erforderlich sind.
Ein ähnliches Konzept gilt für 384-Well-Layouts im Low- oder Small-Volume-Format (manchmal auch als "High Base" bezeichnet). Diese Platten haben die gleiche Well-Größe wie ein 1536-Well-Layout mit den Außenmaßen und Well-Positionen einer 384-Well-Platte. Auch das Probenvolumen kann im Vergleich zu einer 384-Well-Standardplatte um mehr als 50 % reduziert werden. Neben dem Volumen wird auch die Form der Wells beeinflusst: Während die normalen 384-Well-Layouts quadratische Wells haben, sind die Low-Volume-Wells rund.
Tabelle 1: Vergleich der unterschiedlichen Füllvolumina der verschiedenen Layouts.
| Anzahl der Wells | Empfohlenes Füllvolumen |
| 6 | 2-5 mL |
| 12 | 2-4 mL |
| 24 | 0,5-3 mL |
| 48 | 0,5-1,5 mL |
| 96 | 100-300 µL |
| 96 half area | 50-170 µL |
| 384 | 30-100 µL |
| 384 low volume/small volume | 5-25 µL |
| 1536 | 5-25 µL |
| 3456 | 1-5 µL |
Im Allgemeinen können Formate mit höherer Dichte (d. h. 1536- und 3456-Well) nicht von Hand pipettiert werden, sondern es wird eine Pipettiermaschine benötigt. Bei 384 Wells ist das manuelle Pipettieren zwar noch möglich, aber mühsam und in der Regel nicht zu empfehlen. Folglich muss man abwägen, ob die höheren Handhabungskosten, die mit der Arbeit mit 1536- oder 3456-Well-Mikroplatten verbunden sind, durch die Kosteneinsparungen aufgrund der Miniaturisierung aufgewogen werden. Dies ist typischerweise bei Hochdurchsatz-Screening-Einrichtungen der Fall, nicht aber bei den meisten Life-Science-Laboren.
ELISA-Platten werden in der Regel mit 96 Wells geliefert und bestehen oft aus zwölf separaten Streifen mit je acht Wells (Abb. 3). Diese Architektur vereinfacht die separate Verwendung und Handhabung von Teilen der Platte.
Mikrotiterplatten können aus verschiedenen Materialien hergestellt werden. Die am häufigsten verwendeten sind die Polymere Polycarbonat, Polystyrol und Cycloolefin. Die Wahl des Polymers wirkt sich auf die Lichtdurchlässigkeit, die Autofluoreszenz, die Wasserabsorption und den Gasaustausch aus und beeinflusst folglich die möglichen Anwendungen und die Qualität der Tests.
Das am häufigsten verwendete Material für Mikroplatten ist Polystyrol. Aufgrund seiner Transparenz eignet es sich ideal für optische Nachweise, Absorptionstests (z. B. ELISA) und mit moderaten Modifikationen auch für die Mikroskopie. Allerdings lässt Polystyrol kein UV-Licht durch (< 320 nm) und ist daher für die Quantifizierung von RNA und DNA ungeeignet. Für diesen Zweck gibt es Cycloolefin-Copolymere (COC) mit verbesserter UV-Lichtdurchlässigkeit im Bereich von 200 - 400 nm und mit geringer Autofluoreszenz (Abb. 4).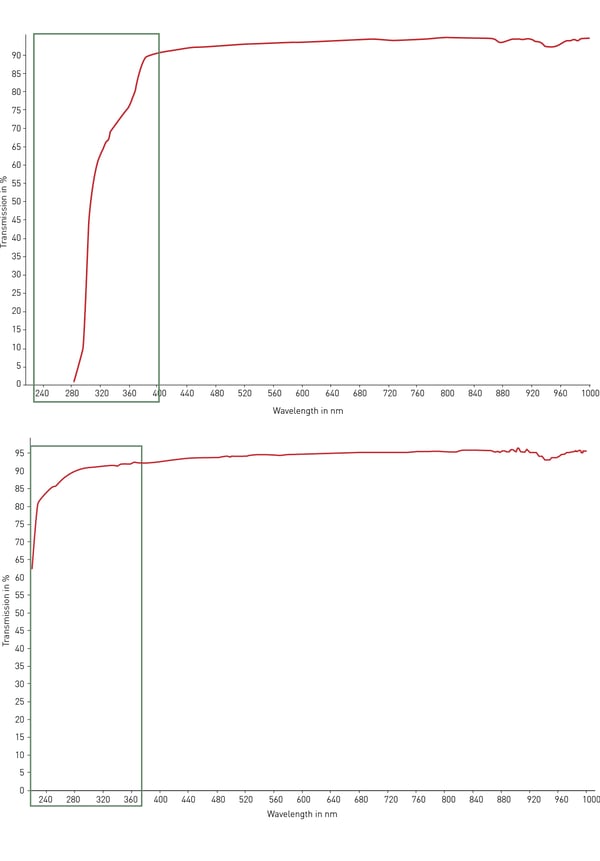
Für optische und mikroskopische Anwendungen sowie für High-Content-Screening sind Glas und Quarz die bestmöglichen Materialien hinsichtlich Transparenz, Autofluoreszenz und Lichtdurchlässigkeit. Allerdings sind diese Materialien sehr teuer, zerbrechlich und können in der Regel nicht entsorgt werden.
Neben den optischen Eigenschaften spielen bei zellbasierten Anwendungen auch die Wasseraufnahme und der Gasaustausch eine wichtige Rolle. Darüber hinaus beeinflussen die mechanischen Eigenschaften die Handhabung, insbesondere durch automatisierte Systeme. Thermische Eigenschaften können bei Hochtemperaturanwendungen (z. B. PCR-Platten) oder bei der Notwendigkeit von Versiegelungen eine Rolle spielen.
Polycarbonat und Polypropylen werden hauptsächlich für PCR-Platten (Abb. 5) und für Proben verwendet, die starken Temperaturschwankungen ausgesetzt sind (z. B. Lagerung bei -80 °C). Neben der Temperaturstabilität sind auch die Beständigkeit gegenüber zahlreichen Lösungsmitteln und die biologische Inertheit für die Lagerung erforderlich.
Mikrotiterplatten sind in der Regel in vier Farben erhältlich: transparent, schwarz, weiß und grau (Abb. 6). Je nach verwendetem Detektionsmodus kann sich die Farbe auf das Signal-Hintergrund-Verhältnis und das Übersprechen von Wells auswirken, wenn sehr helle und schwache Proben nebeneinander liegen. Dementsprechend kann eine suboptimale Farbwahl negative Auswirkungen auf Ihre Daten haben.
Klare (auch UV-transparente) Mikrotiterplatten sind für Absorptionstests erforderlich, da bei diesem Detektionsmodus Licht durch die Probe dringen muss.
Schwarze Mikrotiterplatten (die durch das Vorhandensein von Kohlenstoff dunkel erscheinen) löschen das Signal der Probe teilweise aus. Dies geschieht, weil die schwarze Farbe das von der Probe kommende Lichtsignal teilweise absorbiert. Daher eignen sich diese Platten gut für Fluoreszenzintensität, einschließlich FRET, und für Fluoreszenzpolarisationstests. Dabei handelt es sich in der Regel um Detektionsmodi mit einer starken Signalausbeute, und die Verwendung der schwarzen Farbe trägt dazu bei, den Hintergrund, die Autofluoreszenz und das Übersprechen von Vertiefung zu Vertiefung zu reduzieren, was zu einem besseren Signal-Hintergrund-Verhältnis führt.
Schwarze Mikrotiterplatten werden im Allgemeinen nicht für Lumineszenz-, zeitaufgelöste Fluoreszenz- (TRF) und TR-FRET-Tests empfohlen, da diese Nachweismethoden in der Regel eine vergleichsweise geringe Signalausbeute aufweisen, die durch die schwarze Farbe noch weiter abgeschwächt würde. Für diese Assays werden weiße Platten empfohlen, die Titandioxid enthalten. Die weiße Farbe der Wells reflektiert teilweise das Probensignal und trägt dazu bei, es zu maximieren. Der Nachteil ist, dass weiße Mikrotiterplatten auch den Hintergrund erhöhen. Dieses Hintergrundsignal ist bei Lumineszenztests in der Regel jedoch recht gering. Bei TRF eliminiert das verzögerte Messfenster den Einfluss des Hintergrunds.
Eine Zwischenlösung stellen graue Mikrotiterplatten dar. Diese werden speziell für AlphaScreen® und AlphaLISA® empfohlen, da sie zum einen das Übersprechen und den Hintergrund reduzieren und dennoch gute Signale liefern.
Wenn Sie weitere Einzelheiten über den Einfluss der Plattenfarbe auf die Messergebnisse in verschiedenen Detektionsmodi erfahren wollen und Daten zum Nachweis der Auswirkungen sehen möchten, sehen Sie sich bitte unsere HowTo Note 6: How to choose the best microplate colour for my assay an.
Die Wells können entweder rund oder quadratisch sein, wobei letztere entweder gerade oder abgerundete Ecken haben. Quadratische Wells enthalten ein größeres Probenvolumen und erhöhen die Lichtdurchlässigkeit im Vergleich zu runden Wells. Runde Wells haben eine kleinere Gesamtfläche und sind besser zum Schütteln geeignet. Da runde Wells in der Regel keine gemeinsame Wand mit benachbarten Wells haben, werden sie außerdem weniger durch das Übersprechen von Signalen durch die Kunststoffwand der benachbarten Wells beeinträchtigt, wie es bei quadratischen Wells der Fall ist.
Wellböden gibt es ebenfalls in verschiedenen Formen: F-, V-, U- und C-Böden (Abb. 7). Wells mit F-Boden (flach) bieten die beste Lichtdurchlässigkeit, sind ideal für adhärente Zellkulturen und eignen sich zudem für Bottom-Reading-Assays mit Plattenlesegeräten oder Mikroskopen.
Wells mit V-Boden (konisch) ermöglichen aufgrund ihrer Form die maximale Wiederfindung von kleinen und wertvollen Proben. Die konische Form ist jedoch nachteilig für spektrophotometrische oder bildgebende Anwendungen. Dementsprechend werden V-förmige Wells hauptsächlich für die Probenlagerung und das präzise Pipettieren verwendet.
Ein abgerundeter Wellboden (U-Boden) erleichtert das Mischen, Waschen und Beschichten. Wells mit U-Boden ermöglichen ein einfaches und rückstandsfreies Pipettieren und werden in der Regel für Zellen in Suspension und für Sphäroide verwendet.
Wells mit gewölbtem Boden (C-Boden) sind ein Kompromiss zwischen F-Boden- und U-Boden-Wells. Durch den flachen Boden sind sie für optische Messungen geeignet, während die abgerundeten Kanten das Mischen und Waschen erleichtern.

Die Oberflächeneigenschaften der Wells spielen eine wichtige Rolle. Hier interagieren die Probe und das Material des Wells miteinander. In der Regel gibt es drei Haupttypen von Mikroplatten: nicht bindende oder niedrig bindende, mittel bindende und hoch bindende. Die Bindung wird durch die physikalischen Eigenschaften des Materials beeinflusst und kann durch das Aufbringen verschiedener Beschichtungen verändert werden.
Für biochemische Spektroskopie und Hochdurchsatz-Screening-Anwendungen ist Polystyrol ohne Beschichtung in der Regel das Material der Wahl und wird als mittelstark bindend kategorisiert.
Nicht-bindende Platten verhindern die Bindung von Nukleinsäuren, Proteinen und Peptiden an die Oberfläche der Vertiefungen. Hier verringert eine spezifische Beschichtung den Assay-Hintergrund und verbessert das Signal-Rausch-Verhältnis.
Hochbindende Mikroplatten werden in der Regel für Assays verwendet, bei denen Moleküle an der Oberfläche der Vertiefung immobilisiert werden müssen. Eine der bekanntesten Anwendungen sind ELISA-Tests. Hier wird durch spezielle Beschichtungen und Behandlungen eine bestimmte Anzahl von hydrophilen Gruppen eingebracht, um die passive Adsorption von Biomolekülen (z. B. Antikörpern) zu erleichtern. Mittel- und hochbindende Platten unterscheiden sich in der Regel durch die Anzahl der verfügbaren polaren Gruppen.
Ein Beispiel dafür, wie sich die Plattenbeschichtung auf biologische Daten auswirken kann, wurde anhand eines Proteasom-Aktivitätstests gezeigt, der mit nicht-bindenden, mittel-bindenden und hoch-bindenden Platten durchgeführt wurde. In dieser Studie erzielten die Forscher unterschiedliche Ergebnisse und zeigten, dass die Leistung des Proteasom-Assays durch die Eigenschaften der Mikroplatten beeinflusst wird. Die Proteasom-Aktivität wurde mit einem fluoreszierenden Proteasom-Substrat, 7-Amino-4-Methylcumarin (AMC), einem weit verbreiteten Marker für diesen Zweck, bestimmt. Da die Anregungs- und Emissionsspektren von gebundenem und ungebundenem AMC unterschiedlich sind, konnte das durch proteolytische Spaltung freigesetzte freie AMC mit einem Fluoreszenzplattenlesegerät leicht nachgewiesen werden. Die Standardkurven des freien AMC zeigten jedoch erhebliche Unterschiede zwischen den drei Plattentypen. Wie erwartet lieferte die Platte mit hohem Bindungsgrad das geringste Signal. Daher sollten verschiedene Mikrotiterplatten ausgewertet werden, um die beste Platte für den Assay sowie die Rolle möglicher plattenspezifischer Effekte zu ermitteln.4
Unterschiedliche Plattenbeschichtungen können auch einen wesentlichen Einfluss auf die Bildung von Menisken an der Flüssigkeitsoberfläche haben, die sich aufgrund einer veränderten Weglänge erheblich auf absorptionsbasierte Messungen auswirken können, wie in der HowTo Note: How to deal with path length and meniscus in microplates erläutert.
Normale Platten können nicht für Zellkulturen und zellbasierte Assays verwendet werden, da sie in der Regel nicht steril sind. Zusätzlich zur Sterilität sind für adhärente Zellen spezielle hydrophile Oberflächenbehandlungen erforderlich, um das Anhaften der Zellen am Boden der Wells zu erleichtern. Solche hydrophilen Behandlungen werden üblicherweise als "tissue culture-treated" oder TC-treated bezeichnet. Es gibt auch Beschichtungen auf der Basis von extrazellulären Matrixproteinen wie Kollagen, Fibronektin und Laminin sowie synthetische Beschichtungen wie Polylysine. Eine zellabweisende Oberfläche ist in der Regel für Suspensionszellen, Organoide und Sphäroide geeignet.
Da zelluläre Assays manchmal über mehrere Stunden oder Tage hinweg ausgewertet werden, kann die Verdunstung aus den Wells mit Zellen die Ergebnisse möglicherweise beeinflussen und letztlich zu einer verminderten Lebensfähigkeit der Zellen führen. Einige Hersteller bieten Platten mit einer äußeren Vertiefung an, die alle Wells umringt und mit Flüssigkeit gefüllt werden kann. Dieser hilft, die Wells zu isolieren und so die Verdunstung zu verhindern, insbesondere bei Randwells, die ein erhöhtes Verdunstungsrisiko aufweisen.
Bei der Durchführung von zellbasierten Assays wird in der Regel aus mehreren Gründen empfohlen, ausgehend von der Unterseite der Wells zu messen. Bei normalen weißen oder schwarzen Platten ist die Messung von unten nicht möglich, und es müssen Platten mit transparenten Böden verwendet werden. Die Wände der Wells können je nach Assay weiß oder schwarz sein. Der klare Boden kann aus verschiedenen Materialien - von Kunststoff (Polystyrol oder Cycloolefin-Copolymer) bis hin zu Glas oder Quarz - bestehen. Im Vergleich zu Kunststoff ist die Detektion mit Glas und umso mehr mit Quarz wesentlich besser. Allerdings sind Platten aus Glas und Quarz auch wesentlich teurer. Außerdem sind Glas- und Quarzplatten keine Einwegprodukte und müssen nach jedem Gebrauch gereinigt und autoklaviert werden, um sie zu sterilisieren. Daher muss man entscheiden, ob die bessere Leistung, die mit höheren Kosten und einem größeren Wartungsaufwand verbunden ist, die Verwendung einer solchen Platte im Vergleich zu einer billigeren Einweg-Mikroplatte mit einem durchsichtigen Kunststoffboden und einfacherer Handhabung gerechtfertigt ist.
Verwendung in Mikroplatten-Readern
Mikroplatten-Lesegeräte detektieren und quantifizieren Lichtsignale, die von flüssigen Proben in mikroplattenbasierten Assays erzeugt werden. Diese Laboranalysegeräte werden in den Biowissenschaften und der pharmazeutischen Industrie eingesetzt, um chemische, biologische oder physikalische Reaktionen zu quantifizieren. Neben biologischen, zellulären, biochemischen, pharmazeutischen und arzneimittelentdeckenden Anwendungen werden Mikroplatten-Lesegeräte auch in der Umweltforschung und in der Lebensmittel- oder Kosmetikindustrie eingesetzt.
Mikroplatten-Lesegeräte gibt es entweder als Einzel- oder als Multimodus-Geräte, die in der Lage sind, Proben in verschiedenen Modi wie Absorption, Fluoreszenzintensität, Lumineszenz oder zeitaufgelöster Fluoreszenz, TR-FRET, Fluoreszenzpolarisation und AlphaScreen zu quantifizieren. Je nach Methode der Wellenlängenauswahl können die Plattenlesegeräte entweder monochromator- oder filterbasiert sein.
Ihr Einsatz verbessert in der Regel die Effizienz der Laborpraxis und hilft, Kosten für Reagenzien zu sparen und die Betriebszeit zu verkürzen. Einen Überblick darüber, wie Mikroplatten-Reader heute eingesetzt werden, finden Sie in unserer Datenbank mit Anwendungshinweisen.
Trotz der ANSI/SLAS-Normen weisen die Platten verschiedener Hersteller geringfügige Abweichungen bei den Abmessungen und der Position der Wells auf. Dies kann die Messdaten beeinflussen. Schon ein kleiner Versatz in der Tiefe oder Breite der Wellposition kann bei einer Zeile mit 24 bzw. 48 Wells (bei 384- bzw. 1536-Well-Platten) dazu führen, dass nicht mehr in der Mitte des Wells gemessen wird, sondern im schlimmsten Fall an der Kunststoffwand zwischen zwei Proben.
Daher verfügen die BMG LABTECH-Reader über eine Datenbank zur Auswahl von Mikrotiterplatten, die mehr als 50 verschiedene Plattenlayouts von verschiedenen Herstellern enthält.
Neben den Mikroplatten-Lesegeräten gibt es auch andere Geräte, die Mikroplatten transportieren oder verwenden. Diese Geräte werden speziell in der Laborautomatisierung eingesetzt. Einige Beispiele sind Liquid Handler und Washer zum Abgeben oder Entfernen von Flüssigkeiten auf und von verschiedenen Platten, Roboterarme und Förderbänder zum Transport von Platten zwischen Geräten, Plattenstapler zur kurzfristigen Lagerung und Plattenhotels oder Inkubatoren zur längerfristigen Lagerung. Darüber hinaus bringen Plattenversiegler und -entsiegler Versiegelungsfolien auf und entfernen sie. Ein Beispiel für die automatisierte Handhabung von Mikroplatten ist in dem folgenden Video zu sehen:

Die BMG LABTECH Multi-Mode-Reader kombinieren Leistung mit miniaturisierten Assays, Kompatibilität mit automatisierten Optionen zur Handhabung, kurzen Messzeiten und führen zu Einsparungen bei Material und anderen Ressourcen.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series