
PHERAstar FSX
Powerful and most sensitive HTS plate reader


マイクロプレートには、様々な色、材質、ウェル密度、形状があります。お客様のアプリケーションに最適なフォーマットをお選びいただけます。
マイクロプレートとは、小さなサンプルチューブとして使用される複数の穴(ウェル)を持つ平らな実験器具です。マイクロプレートは、マイクロタイタープレートまたはマルチウェルとも呼ばれます。通常、6、12、24、48、96、384、1536ウェルの形式があり、96ウェルプレートが最も一般的に使用されています。ウェルの大きさに応じて、マイクロリットルからミリリットルの試料を入れることができます。
マイクロプレートは、様々なサンプルの調製、取り扱い、検査、処理、管理を容易にします。今日では、臨床診断や分析研究だけでなく、ライフサイエンスや製薬研究においても当たり前のように使用されています。 酵素結合免疫吸着測定法(ELISA)は、最も使用されているアプリケーションの1つです。サンプルの検出や定量だけでなく、マイクロプレートのフォーマットでのサンプルの保存、ろ過、分離、混合なども行われ、その用途はライフサイエンス分野で広く使用されています。

マイクロプレートは1951年、インフルエンザの流行により実験器具が不足したことをきっかけに、ハンガリーの微生物学者Gyula Takátsy博士によって作られました(図1)。Takátsy博士は、臨床試験を進めるために安価な解決策を見つける必要がありました。彼は、一度に多くのサンプルを検査するにはコストがかかりすぎること、複数のサンプルを隣り合わせに配置することで処理能力を大幅に向上できることに気がつきました。そこで彼は、12ウェルを8行(8×12=96個)に並べ、ワイヤーループで連結して最初のマイクロプレートを作成しました。この方法によって、彼はピペッティングの時間を節約することができたのです。
1960年代、彼のこの発明は徐々に人気を博し、世界中の研究室で生物医学検査の標準容器として採用されました。
1980年代後半には、成型バージョンが登場し、さらに普及が進みました。これにより、1枚あたりの価格が下がり、生産能力が向上しました。その後の数年間で、マイクロプレートはさらに改良され、科学界の様々なニーズに合うよう、複数のバリエーションが開発されました。
1990年代、Society for Biomolecular Screening学会(SBS)は、その特徴と形状を標準化する取り組みを開始しました。特徴には、主にウェルの数、形状、寸法、および一般的な寸法や材質などの特性が含まれました。2003年、米国規格協会(ANSI)は、ウェル径、深さ、間隔、一般寸法(127.76mm×85.48mm)を含む標準化された特徴一式を提案し、公表しました1。
標準化は、特にラボオートメーションやラボ用機器の製造に恩恵をもたらし、広く使用されるようになりました。その結果、マイクロプレートは創薬やライフサイエンス研究を効果的にサポートするものとして、さらに人気が高まりました。実際、2000年だけで約1億2,500万個が使用されたと推定されています2。
2010年、SBSとAssociation for Laboratory Automation (ALA)は合併し、Society for Laboratory Automation and Screening (SLAS)を設立しました。それ以来、マイクロプレートのSBS規格はANSI/SLAS規格と呼ばれるようになっています。
ウェルの数だけでなく、マイクロプレートには様々な材質や色、ウェルの形状や容量があります。多くの選択肢があるため、特定のアッセイに最適なものを選ぶのが難しい場合もあります。ここでは、吸光度測定にポイントを置いて、主な特徴をまとめます。
各メーカーのマイクロプレートの種類によってはサイズやウェルの位置に若干の違いはありますが、すべてのマイクロタイタープレートのフットプリント寸法は同じとなっています。ウェルは長方形のマトリックスに配列され、6、12、24、48、96、384、1536ウェルのフォーマットがあります(図2)。3456ウェルのプレートもありますが、あまり使用されていません。
 各プレートの容量はフォーマットによって異なります。最も使用されているのは96ウェル(最大300μL/ウェル)です。それ以上の高密度プレートは主に、少量化を目的として採用されます。384ウェル(最大100µL/ウェル)、1536ウェル(最大15µL/ウェル)、さらには3456ウェル(最大5µL/ウェル)は、より多くのサンプルに対応できるだけでなく、試薬量を減らし、結果としてコストの削減につながります(表1)。
各プレートの容量はフォーマットによって異なります。最も使用されているのは96ウェル(最大300μL/ウェル)です。それ以上の高密度プレートは主に、少量化を目的として採用されます。384ウェル(最大100µL/ウェル)、1536ウェル(最大15µL/ウェル)、さらには3456ウェル(最大5µL/ウェル)は、より多くのサンプルに対応できるだけでなく、試薬量を減らし、結果としてコストの削減につながります(表1)。
一般的に、最大容量の3分の1が、効率的で現実的な測定を行うために推奨される最低量です。したがって、標準的な96ウェルマイクロタイタープレートでは100 µLを下回らないようにしてください。
96ウェルハーフエリアプレート(最大170 µL/ウェル)は、384ウェルとの中間的な選択肢です。基本的に、96ウェルの外形寸法とウェル間隔を保ちながら、ウェルの底面積は半分になります。ウェルはより小さくなり、サンプル量を最大50%削減できます。このプレートは通常、サンプル量を減らしたいが自動化やスループットは必要ない場合に、384ウェルの代替として使用されます。
同様のコンセプトは、低容量または小容量フォーマットの384ウェルプレートにも適用されます(上げ底になっているため「ハイベース」とも呼ばれることもあります)。これらのプレートは、1536ウェルプレートと同じ容量で、384ウェルプレートの外形寸法とウェル間隔を有します。標準的な384ウェルと比較すると、サンプル量は50%以上削減できます。同様に、ウェルの形状も少量化に影響します。通常の384ウェルプレートのウェルが四角形であるのに対し、低容量のウェルは円形です。
表1:各種プレートの容量比較
| ウェルの数 | 推奨容量 |
| 6 | 2-5 mL |
| 12 | 2-4 mL |
| 24 | 0.5-3 mL |
| 48 | 0.5-1.5 mL |
| 96 | 100-300 µL |
| 96 ハーフエリア | 50-170 µL |
| 384 | 30-100 µL |
| 384 低容量/小容量 | 5-25 µL |
| 1536 | 5-25 µL |
| 3456 | 1-5 µL |
一般に、高密度プレート(1536ウェルや3456ウェル)では、手動でのピペッティングはできず、自動分注システムが必要となります。384ウェルでは手作業による分注も可能ですが、手間がかかるため通常は推奨されません。その結果、1536ウェルや3456ウェルのプレートで作業する際に増加するハンドリングコストと、高密度プレートによる微量化によって見込まれるコスト削減とが釣り合うかどうかを検討する必要があります。これは一般的にハイスループットスクリーニングを行う企業で求められる条件であり、ほとんどのライフサイエンス研究所では当てはまりません。
ELISA用プレートは通常96ウェルで、12個の独立した8ウェルストリップで構成されています(図3)。この構造により、プレートを一部だけ使用したい場合でも、容易に取り扱うことができます。
マイクロタイタープレートは様々な材質から製造されています。最も一般的に使用されているのは、ポリカーボネート、ポリスチレン、シクロオレフィンなどのポリマーです。ポリマーの選択は、光透過性、自家蛍光性、吸水性、ガス交換性に影響し、その結果、取り扱い方法、アプリケーション内容、アッセイの質にも影響します。
プラスチック製実験器具の材質として最も使用されているのはポリスチレンです。その透明性により、光学的検出、吸光度アッセイ(ELISAなど)、そして適切に調整すれば顕微鏡観察にも理想的です。しかし、ポリスチレンは紫外線(<320 nm)を透過しないため、 RNAやDNAの定量には不適切です。この場合は、200~400 nmの範囲で紫外線透過率が改善され、自家蛍光が低い(図4)シクロオレフィンコポリマー(COC)を使用したプレートが適しています。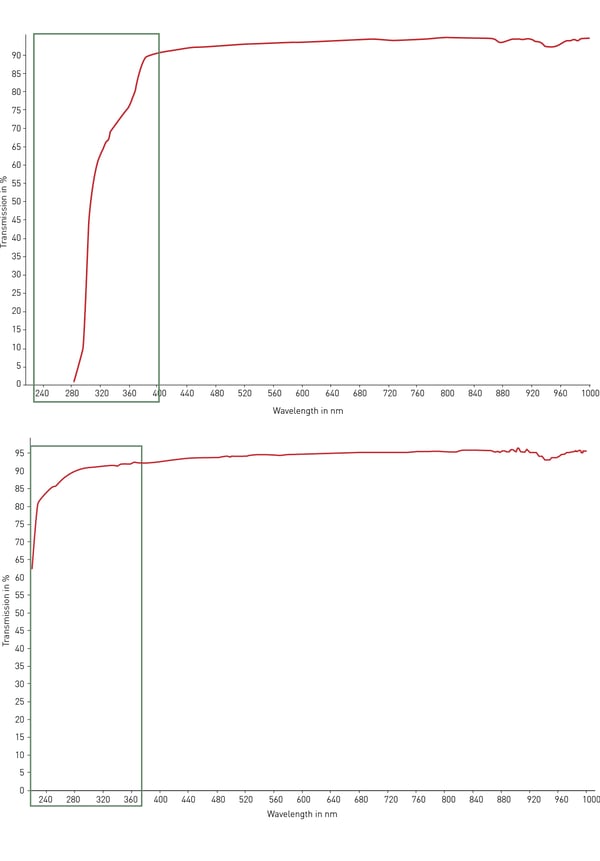 画像検出および顕微鏡観察、ハイコンテンツスクリーニング用には、ガラスや石英が、透明性、低自家蛍光、光透過性において最良の材質です。しかし、これらは非常に高価で壊れやすく、通常は使い捨てにはできません。
画像検出および顕微鏡観察、ハイコンテンツスクリーニング用には、ガラスや石英が、透明性、低自家蛍光、光透過性において最良の材質です。しかし、これらは非常に高価で壊れやすく、通常は使い捨てにはできません。
光学的特性のほか、吸水性とガス交換性が、細胞ベースのアプリケーションにとって重要な役割を果たします。さらに、機械的特性は、特に自動化システムによるハンドリングに影響します。熱特性は、高温用途(PCRプレートなど)やシーラーが必要な場合に需要な役割を果たすことがあります。
ポリカーボネートとポリプロピレンは、主にPCRプレート(図5)や温度変化の大きいサンプル(例:-80℃保存)に使用されます。サンプルの保存を目的とする場合は、温度安定性に加えて、多くの溶媒に対する耐性や生物学的不活性も必要となります。
マイクロプレートには通常、透明、黒、白、グレーの4色があります(図6)。使用する検出モードにもよりますが、非常に明るいサンプルと暗いサンプルが隣接している場合、色はシグナル/バックグラウンド比やウェル間のクロストークに影響を与える可能性があります。つまり、最適でない色の選択は、データに悪影響を及ぼす可能性があります。
 吸光度アッセイでは、光がサンプルを通過する必要があるため、透明(UV透明を含む)なプレートが必要です。
吸光度アッセイでは、光がサンプルを通過する必要があるため、透明(UV透明を含む)なプレートが必要です。
黒色プレート(カーボンを含むため暗い)は、サンプルのシグナルを部分的に消光します。黒色は、反応に関係のない発光を部分的に吸収します。その結果、これらのプレートはFRETを含む蛍光強度や蛍光偏光アッセイに適しています。蛍光測定は強い発光を伴う検出モードですが、黒色を使用することで、バックグラウンド、自家蛍光、ウェル間のクロストークを低減し、より優れたシグナル/ブランク比を得ることができます。
黒色プレートは通常、発光、時間分解蛍光(TRF)、TR-FRETアッセイには推奨されません。なぜなら、これらの検出モードはシグナル強度が比較的低く、黒色によってさらに消光されてしまうからです。これらのアッセイには、二酸化チタンを含む白色プレートが推奨されています。ウェルの白色はサンプルシグナルを部分的に反射し、シグナルを最大化するのに役立ちます。欠点は、白色プレートはブランクシグナルも増加させることです。しかし実際には、発光アッセイではノイズはかなり低くなります。TRFでは、ディレイ後の長寿命蛍光を測定することでバックグラウンドの影響を排除します。
黒と白の中間的なソリューションとして、グレーのマイクロプレートがあります。黒色プレートのようにクロストークやバックグラウンドを減らしつつ、白色プレートのように良好なシグナルが得られるため、AlphaScreen®やAlphaLISA®に特に推奨されています。
異なる検出モードでプレートの色がどのように測定結果に影響するかをさらに詳しく知りたい場合や、その効果を証明するデータをご覧になりたい場合は、HowTo Note 6: How to choose the best microplate color for my assayをご参照ください。
上から見たウェルの形状には円形と四角形があり、四角形の角は直線または丸みを帯びています。四角形のウェルは円形のウェルに比べ、ウェル容量が多く、光透過面積も大きくなります。円形ウェルは総面積が小さく、振とうに適しています。さらに、円形ウェルは隣接するウェルと共通の壁を持たないため、共通の壁をもつ四角形ウェルよりも周辺ウェルのクロストークの影響を受けにくくなっています。
ウェル底にも様々な形状があります。F底、V底、U底、C底があります(図7)。F底(平らな)ウェルは光透過性が最も良く、接着性細胞培養に理想的で、プレートリーダーでの下方測定や顕微鏡での観察に適しています。
V底(円錐形)ウェルは、その形状のため、少量の貴重なサンプルを最大限に回収することができます。しかし、この形状は分光光度計やイメージングのアプリケーションには適していません。したがって、V底ウェルプレートは主にサンプルの保存や正確なピペッティング用に使用されます。
ラウンド形状底(U底)ウェルは、ミキシング、洗浄、コーティングを容易にします。U底ウェルプレートは、ピペッティング時のサンプル残量を少なくできるほか、懸濁液中の細胞やスフェロイドの抽出にも適しています。
カーブ底(C底)ウェルは、F底とU底の中間のウェルです。底面が平らなため光学測定に適しており、縁が丸いためミキシングや洗浄が容易になります。

ウェルの表面特性はアッセイにおいて重要な役割を果たします。ウェル内ではサンプルとウェル材質が相互に作用し合います。一般的に、非結合性(低結合性)、中結合性、高結合性の3種類のマイクロプレートがあります。これらの結合性は材質の物理的性質に影響され、それぞれに適したコーティングを施すことで修正できます。
生化学的分光学やハイスループットスクリーニングの用途では、コーティングのないポリスチレンが一般的に選択され、中結合に分類されます。
非結合性プレートは、核酸、タンパク質、ペプチドなどがウェル表面に吸着するのを防ぎます。特異的コーティングによってアッセイバックグラウンドを減少させ、S/Nを改善します。
高結合性プレートは通常、ウェル表面へ分子の固定が必要なアッセイに使用されます。最もよく知られた用途としてELISAアッセイが挙げられます。生体分子(抗体など)を吸着しやすくさせるために、特定のコーティングや処理を行い、一定数の親水基を導入しています。中結合性プレートと高結合性プレートは、吸着のための極性基の数が異なります。
プレートのコーティングが生物学的データにどのような影響を与えるかの一例を、非結合性、中結合性、高結合性プレートを用いたプロテアソーム活性試験で示しました。研究者らは結合性の違いによって異なる結果が得られたことから、プロテアソームアッセイの性能がマイクロプレートの特性に影響されることを示しました。プロテアソーム活性は、蛍光性プロテアソーム基質、7-アミノ-4-メチルクマリン(AMC)を用いて測定されます。結合したAMCと結合していないAMCの励起スペクトルと発光スペクトルは異なるため、タンパク質分解によって遊離したAMCを蛍光プレートリーダーで容易に検出することができました。しかし、遊離AMCの標準曲線は、3種類のプレートで大きな違いが見られました。予想どおり、高結合性プレートが最も低いシグナルを示しました。このように、様々なマイクロプレートを評価してプレートがアッセイに与える影響を確認し、最適なマイクロプレートを決定する必要があります4。
プレートコーティングの違いは、液面のメニスカス形成にも大きな影響を与える可能性があります。HowTo Note:How to deal with path length and meniscus in microplatesで説明されているように、光路長が変化するため、吸光度測定に実質的な影響を与える可能性があります。
通常のプレートは一般的に非滅菌であるため、細胞培養や細胞ベースのアッセイには使用できません。それに加え、細胞ベースのアッセイにはウェル底への細胞接着を促進するため特定の親水性表面処理が必要です。このような親水性処理は、通常「細胞培養処理」またはTC処理と呼ばれます。コラーゲン、フィブロネクチン、ラミニンのような細胞外マトリックスタンパク質をベースにしたコーティングや、ポリリジンのような合成コーティングもあります。逆に、細胞懸濁液、オルガノイド、スフェロイドには、細胞をはじく表面が必要です。
細胞アッセイは数時間から数日にわたって測定されることがあるため、細胞を含むウェルからの蒸発が結果に影響を与え、最終的には細胞の生存率低下につながる可能性があります。これに対処するためにウェルエリアの外側に専用の溝を設け、液体を満たせるようにしたプレートを提供しているメーカーもあります。溝に液体を満たすことでウェルの断熱に役立ち、特に蒸発のリスクがある周辺のウェルからの蒸発を防ぎます。
細胞ベースのアッセイを行う場合、ウェルの底から測定する下方測定が推奨されることがあります。通常の白色または黒色プレートでは、ウェルの底からの読み取りは不可能であるため、透明な底のタイプを使用する必要があります。ウェルの壁はアッセイに応じて白または黒にすることができます。透明な底の材質は、プラスチック(ポリスチレンやシクロオレフィンコポリマー)からガラスや石英まで様々です。プラスチック製に比べ、ガラス製、石英製は検出感度が格段に高いものの、高価になります。さらに、ガラスや石英のプレートは使い捨てではないため、使用のたびに洗浄し、オートクレーブで滅菌する必要があります。底が透明なプラスチック製の安価で使いやすい使い捨てマイクロプレートと比べて、高額でメンテナンスの手間を伴うガラス底プレートを使うだけの優れた結果が得られるかどうかを、総合的に判断する必要があります。
マイクロプレートリーダーは、マイクロプレートを使用したアッセイにおいて、液体サンプルから発生する光シグナルを検出・定量します。ライフサイエンスや製薬業界において使用されている実験機器は、化学的、生物学的または物理的な反応を定量化するために用いられています。生物学、細胞学、生化学、製薬、創薬アプリケーションに加え、環境研究、食品・化粧品産業でもマイクロプレートリーダーは使用されています。
マイクロプレートリーダーは、吸光度、蛍光強度、発光、時間分解蛍光、TR-FRET、蛍光偏光、AlphaScreenなど、異なるモードでサンプルを測定することができるシングルモードまたはマルチモードの測定機器です。波長選択方法によって、プレートリーダーはモノクロメーター式またはフィルター式に分類されます。
マイクロプレートの使用は、実験手順を効率化し、試薬コストの節約と作業時間の短縮に役立っています。今日、マイクロプレートリーダーがどのように使用されているかについては、当社のアプリケーションノートデータベースをご覧ください。
ANSI/SLASの規格があるにもかかわらず、異なるメーカーのプレートには寸法やウェル位置にわずかな違いがあり、これが測定データに影響を与える可能性があります。24ウェルや48ウェルプレートでは、ウェル位置の深さまたは幅にわずかなずれがあっても問題になりにくいですが、384ウェルや1536ウェルプレートでは、ウェルの中心で測定されず、最悪の場合2つのウェル間の壁で測定が行われてしまう可能性があります。
そのため、BMG LABTECH社のリーダーには、異なるメーカーの50種類以上のプレートレイアウトを含むマイクロプレート選択データベースが標準装備されています。
マイクロプレートリーダーのほかにも、マイクロプレートを処理または管理する様々な機器があります。これらの機器は特にラボの自動化に使用されます。いくつかの例としては、異なるプレートへの液体の分注や除去に使用されるリキッドハンドラーやウォッシャー、機器間のプレート搬送に使用されるロボットアームやコンベアベルト、短期間の保管に使用されるプレートスタッカー、長期保管に使用されるプレートホテルやインキュベーターなどがあります。さらに、プレートシーラーやデシーラーは、シーリングフォイルを貼付・剥離するために使用されます 。自動化されたハンドリングの一例を以下のビデオで見ることができます:

BMG LABTECH社のマルチモードリーダーは、小型化されたアッセイ、自動化されたハンドリングオプションとの互換性、短い測定時間などの性能を兼ね備えており、材料やその他の資源の節約につながります。
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series