
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Utilizzate la polarizzazione di fluorescenza per studi di legame, applicazioni di screening e analisi delle interazioni molecolari.
La polarizzazione di fluorescenza (FP) è un metodo di rilevamento basato sulla fluorescenza, ampiamente utilizzato per monitorare le interazioni molecolari in soluzione. A differenza dell'intensità di fluorescenza, che siconcentra sulla quantificazione dell'intensità di emissione a una specifica lunghezza d'onda e trascura la sua polarizzazione, la polarizzazione di fluorescenza analizza specificamente come output l'intensità di emissione di diversi piani di polarizzazione.
La FP è tipicamente utilizzata per valutare le interazioni biomolecolari, come il legame proteina-proteina e proteina-DNA, nonché l'attività enzimatica. È stata adottata nella ricerca di base e nello screening ad alto rendimento.
Inizialmente, la polarizzazione di fluorescenza è stata utilizzata principalmente in campo diagnostico. Un immunodosaggio FP è stato descritto per la prima volta negli anni '60. Nella ricerca sulle scienze della vita, le applicazioni sono state inizialmente limitate a causa della mancanza di strumenti sensibili. Attualmente, la FP sta conoscendo una forte popolarità nella ricerca biologica. Ciò è dovuto principalmente alle maggiori prestazioni e sensibilità dei modernilettori di micropiastre, ingrado di fornire risultati robusti con una variabilità minima e finestre di dosaggio più ampie.
La luce è un'onda elettromagnetica il cui campo elettrico oscilla perpendicolarmente alla direzione di propagazione. La luce non polarizzata (non polarizzata) è definita come luce in cui la direzione dell'oscillazione del campo elettrico fluttua in modo casuale nel tempo. Le comuni sorgenti luminose come la luce solare e le classiche lampadine a incandescenza e alogene producono luce non polarizzata.
Se la direzione del campo elettrico è limitata a un piano da un filtro specifico, tutte le onde luminose selezionate oscilleranno in un'unica direzione, producendo luce piana o polarizzata. La fonte più comune di luce polarizzata è il laser. La luce non polarizzata può essere vista come un insieme di onde luminose polarizzate su piani diversi, senza uno stato predominante di polarizzazione (fig. 1).
A seconda dell'orientamento del campo elettrico, la luce polarizzata si classifica in lineare, circolare ed ellittica. La polarizzazione lineare, il cui campo elettrico è limitato a un singolo piano lungo la direzione di propagazione, è prevalentemente utilizzata nelle applicazioni delle scienze biologiche e costituisce il fulcro di questo articolo. Per la riflessione e la trasmissione della luce, i due stati di polarizzazione lineare più rilevanti sono quello parallelo e quello perpendicolare (rispetto al piano di incidenza).
Il rilevamento della polarizzazione della fluorescenza si basa sulla teoria generale del rilevamento della fluorescenza allo stato stazionario, che si trova nella pagina dedicata all'intensità della fluorescenza. Inoltre, il rilevamento si basa sul fatto che il grado di polarizzazione di un fluoroforo è inversamente correlato alla sua velocità di oscillazione e sull'osservazione che la luce emessa da un fluoroforo può avere intensità diverse su piani di polarizzazione diversi, tipicamente perpendicolari e paralleli al piano di eccitazione.
Quando la luce piano-polarizzata eccita una molecola fluorescente piccola (tipicamente <1,5 kDa) e non legata (il tracciante), questa emette principalmente luce non polarizzata. Ciò è dovuto al fatto che una piccola molecola libera ruota rapidamente in soluzione durante il tempo che intercorre tra l'eccitazione e l'emissione, e di conseguenza emette luce su piani di polarizzazione diversi (non polarizzata).
Al contrario, se la piccola molecola fluorescente è legata a una più grande (tipicamente >10 kDa), l'aumento del volume molecolare rallenta la sua rotazione e determina l'emissione di luce prevalentemente polarizzata sullo stesso piano della sorgente di eccitazione (fig. 2).
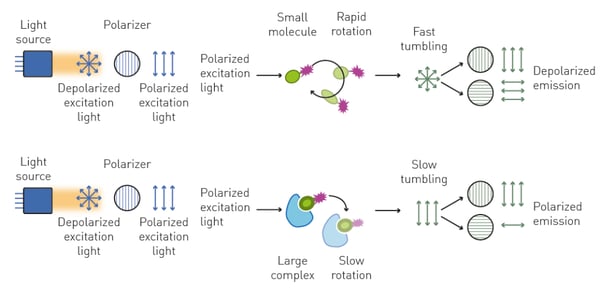
La polarizzazione della fluorescenza è quindi la misura della quantità di rotazione molecolare che avviene nel tempo che intercorre tra l'eccitazione e l'emissione del tracciante. Si calcola con la seguente equazione:
P = (F|| - F⊥)/(F|| + F⊥)
Quantitativamente, è definito come la differenza tra l'intensità di emissione di fluorescenza parallela (F||) e perpendicolare (F⊥) al piano della luce di eccitazione, divisa per l'intensità totale di emissione di fluorescenza.1
Il valore P è un numero senza dimensione, in quanto è un rapporto di intensità luminose. Spesso viene espresso in millipolarizzazione (mP), dove 1 P = 1000 mP. Sebbene P abbia valori che vanno da -330 a 500 mP, questi sono limiti teorici raramente raggiunti. Nelle applicazioni bioanalitiche, i dati tipici vanno da 10 a 300 mP (ad esempio, fig. 3).
Il termine anisotropia è stato introdotto nel 1960 e viene spesso utilizzato nel contesto dell'emissione polarizzata. L'anisotropia (designata come A o r) è il rapporto delle intensità di emissione nell'equazione seguente:
r = (F|| - F⊥)/(F|| + 2 F⊥)
F|| indica l'intensità dopo l'eccitazione polarizzata verticalmente e la polarizzazione verticale sulla luce di emissione. F⊥ indica l'intensità quando si utilizza un polarizzatore verticale sull'eccitazione e un polarizzatore orizzontale sull'emissione. 2
La polarizzazione della fluorescenza e l'anisotropia sono matematicamente correlate e utilizzate in modo intercambiabile. Entrambe derivano dalle intensità di emissione della luce polarizzata e non polarizzata e rappresentano una media degli stati legati/non legati di una molecola fluorescente. Per la maggior parte delle applicazioni, il contenuto informativo delle loro funzioni è identico, poiché l'anisotropia non fornisce alcuna informazione aggiuntiva.3
In genere, la scelta di un termine o dell'altro dipende da considerazioni pratiche e dall'abitudine. La polarizzazione della fluorescenza è più spesso utilizzata per descrivere l'intera tecnologia e in chimica clinica, mentre l'anisotropia è più comune in biofisica ebiochimica.
La polarizzazione di fluorescenza può essere rilevata su un lettore di micropiastre e si basa sulla stessa procedura e impostazione dell'intensità di fluorescenza. Esistono tuttavia alcune differenze, principalmente legate alla selezione dei piani di polarizzazione.
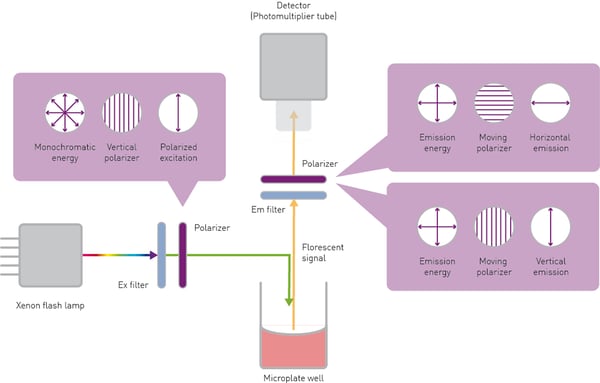
Il campione viene eccitato a una specifica lunghezza d'onda da una luce polarizzata verticalmente (parallela). La sorgente luminosa di eccitazione è tipicamente una lampada allo xeno o alogena. La sua luce bianca viene filtrata spettralmente mediante un filtro o un monocromatore. Il piano di polarizzazione viene selezionato da un filtro specifico chiamato polarizzatore.
Il vettore campo elettrico della luce naturale può assumere qualsiasi direzione di oscillazione rispetto alla direzione di propagazione. I polarizzatori sono elementi ottici, in genere film sottili, in grado di isolare una direzione del vettore elettrico. Il polarizzatore di eccitazione è posizionato tra la sorgente di eccitazione e il campione. L'orientamento relativo del piano verticale trasmette la luce parallela al campione e blocca la luce polarizzata perpendicolarmente.
La luce emessa da un campione viene filtrata spettralmente da un filtro o da un monocromatore per rimuovere le lunghezze d'onda indesiderate. Inoltre, la luce emessa deve essere separata in onde parallele o perpendicolari a seconda del suo orientamento rispetto al piano della luce di eccitazione polarizzata. Ciò è possibile grazie a polarizzatori di emissione posizionati nel percorso della luce tra il campione e il rivelatore, tipicamente dello stesso tipo del polarizzatore di eccitazione. Infine, l'intensità di entrambi i piani polarizzati viene quantificata da un rivelatore, tipicamente un tubo fotomoltiplicatore (PMT).
I due piani vengono rilevati separatamente. L'approccio più semplice consiste nel rilevare i piani paralleli e perpendicolari con due misure sequenziali. Dopo aver rilevato l'intensità della polarizzazione parallela nella prima misurazione, il polarizzatore di emissione ruotato di 90° viene utilizzato per rilevare il piano orizzontale (perpendicolare) (fig. 4).
I lettori di piastre a polarizzazione a fluorescenza di fascia alta, comeil PHERAstarFSX, possonoacquisire i due piani di polarizzazione simultaneamente, grazie alla tecnologia di rilevamento a doppia emissione simultanea. Questo approccio consente di risparmiare tempo e di ridurre la variabilità generata da due misure sequenziali.
In genere, i monocromatori non sono raccomandati per la rilevazione di FP a causa della loro intrinseca bassa trasmissione della luce e dell'elevato background (stray light). Questi fattori contribuiscono ad aumentare la variabilità del campione, influenzando negativamente la finestra e la robustezza del saggio.
Per la rilevazione nell'intervallo UV, i lettori devono essere dotati di una lampada allo xeno. Le lampade alogene sono sconsigliate a causa della loro scarsa emissione al di sotto dei 400 nm. Inoltre, sono necessari polarizzatori UV specifici, poiché quelli normali hanno una scarsa trasmissione nelle lunghezze d'onda UV.
Bassi livelli di polarizzazione (P) indicano che le molecole fluorescenti non si sono legate e si muovono liberamente nella soluzione. Sebbene l'intervallo di misurazione nelle applicazioni bioanalitiche da 10 a 300 mP possa sembrare piuttosto ristretto, è possibile ottenere misure molto precise con deviazioni standard di ± 0,5 mP con lettori di micropiastre multimodali di fascia alta come PHERAstar FSX oCLARIOstarPlus.
La scelta di un colorante fluorescente nei saggi FP è di fondamentale importanza. I loro spettri di eccitazione e di emissione devono differire dalle lunghezze d'onda di altre molecole presenti nella soluzione per ridurre l'autofluorescenza e devono avere un ampio spostamento Stokes per ridurre l'influenza negativa della dispersione della luce. I fluorofori devono essere facilmente coniugabili con il tracciante, ma non devono perturbarne il rotolamento né interferire con l'interazione. Inoltre, devono avere un'elevata resa quantica (cioè un'alta intensità), essere chimicamente stabili e fotostabili.4
I fluorofori più comunemente utilizzati sono l'isotiocianato di fluoresceina (FITC) e coloranti con spettri simili. Recentemente, tuttavia, grazie al miglioramento delle prestazioni dei moderni lettori di micropiastre, si sono diffusi coloranti rossi come Cy3B e Cy5. Poiché la loro intrinseca bassa resa fotonica non rappresenta più una limitazione grazie ai miglioramenti tecnici nella rilevazione del segnale, il loro uso può essere vantaggioso per ridurre i falsi negativi derivati dall'autofluorescenza, che emette comunemente nella gamma del verde e del blu, e i falsi positivi causati da eventi di dispersione della luce.5
Tra gli approcci utilizzati per studiare gli eventi di legame molecolare, la FP è unica. Poiché si basa su un'unica strategia di marcatura fluorescente, non sono necessarie ulteriori fasi di separazione. Di conseguenza, è possibile utilizzare un numero inferiore di reagenti, solitamente meno costosi rispetto ai metodi convenzionali. Inoltre, poiché l'integrità del campione non è compromessa, i campioni possono spesso essere misurati ripetutamente, a condizione che pH, temperatura e viscosità siano costanti.
La FP permette di monitorare direttamente il rapporto libero/legato di un tracciante in soluzione in tempo reale, consentendo l'analisi dell'equilibrio con concentrazioni molto basse (tipicamente fino all'intervallo picomolare). Tuttavia, grazie alla sua natura in tempo reale, gli esperimenti non sono limitati all'equilibrio e le cinetiche di associazione/dissociazione possono essere facilmente analizzate.
La FP è una tecnica omogenea con un semplice protocollo mix-and-read che non richiede la separazione delle specie legate e libere da misurare. I saggi omogenei forniscono una quantificazione più accurata degli eventi di legame, in quanto la reazione di legame non è disturbata da passaggi aggiuntivi. Tuttavia, è importante notare che altri saggi omogenei, come FRET, TR-FRET o AlphaScreen®, richiedonoulteriori reazioni di marcatura oltre alla singola marcatura del tracciante.
Inoltre, la natura raziometrica dell'FP elimina l'influenza negativa che l'assorbanza o il quenching dei composti possono avere sull'acquisizione dei dati e consente la miniaturizzazione. Tutte queste ragioni hanno portato all'adozione dei saggi FP nelloscreening ad alta produttività.
Nonostante tutti i suoi vantaggi, questo sistema di misurazione presenta alcune limitazioni. La FP richiede grandi variazioni del volume molecolare per la generazione del massimo segnale e della finestra del saggio. Nel migliore dei casi, un saggio di legame in polarizzazione di fluorescenza può monitorare l'interazione tra una molecola piccola e una grande e richiede la marcatura del partner di interazione più piccolo con un fluoroforo. Di conseguenza, i traccianti sono solitamente piccole proteine o peptidi, citochine e composti chimici. In genere, questo assicura la massima differenza possibile di volume molecolare al momento del legame e quindi la più ampia finestra di analisi possibile. Il saggio di legame FP non è adatto all'osservazione dell'interazione di due proteine di grandi dimensioni.
Inoltre, l'autofluorescenza dei composti e la dispersione della luce possono causare artefatti. Pertanto, di solito si raccomanda di quantificare il background di fluorescenza di un pozzetto prima dell'aggiunta del colorante fluorescente e di sottrarlo dal calcolo. Poiché l'autofluorescenza è tipicamente meno pronunciata a lunghezze d'onda più elevate, l'adozione di coloranti rossi come il BODIPY TMR o il colorante Cy5 può essere utilizzata per minimizzare il rumore di fondo.6, 7
Il saggio di legame FP può essere impiegato per analizzare gli eventi di interazione o dissociazione molecolare nelle interazioniproteina-ligando opeptide-proteina, nelleinterazioni proteina-DNA e nell'aggregazione proteica prefibrillare. Inoltre, può essere utilizzato per identificare composti interferenti e inibitori non specifici.
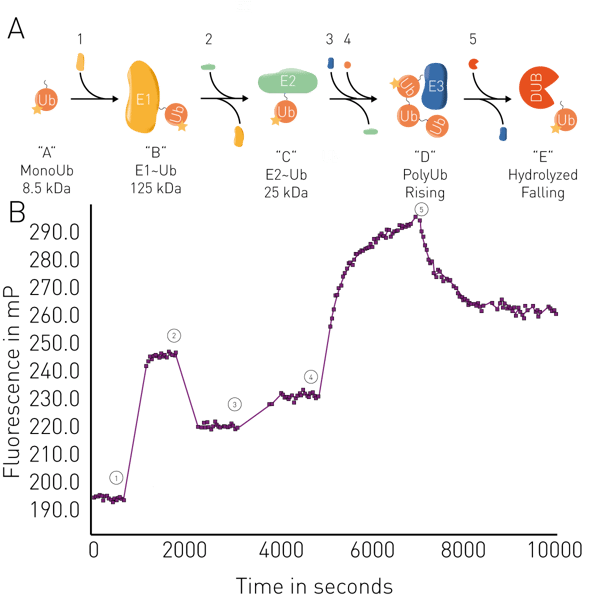
Altre applicazioni includono l'analisi dellafluidità di membrana nei liposomi e nelle membrane mitocondriali e saggi enzimatici come la proteolisi, lasintesi di RNA, la cinetica di legame e laconiugazione/deconiugazione dell'ubiquitina in tempo reale(fig. 5). Le applicazioni in tempo reale per l'ubiquitina possono essere utilizzate, ad esempio, nella degradazione mirata delle proteine per le PROteolysis TArgeting Chimeras (PROTACs) o per le colle molecolari, compresi gli studi della loro attività di legame ai loro bersagli e la cinetica delle interazioni. I saggi di legame FP possono essere utilizzati anche per esaminare la degradazione mirata delle proteine derivante da interazioni specifiche tra degroni e ligasi noti.
Negli anni '90, la FP è stata adottata nell'ambiente dello screening farmacologico per facilitare il processo di scoperta dei farmaci. Al giorno d'oggi, viene utilizzato di routine nelle strutture di screening, grazie al suo formato omogeneo, veloce e quantitativo. Poiché la FP è spesso linearmente proporzionale alla percentuale di tracciante legato/libero, viene spesso impiegata per determinare i valori diIC50 dei candidati farmaci.
Nella scoperta di farmaci, è stato utilizzato per studiare diversi bersagli come GPCR, chinasi, fosfatasi e proteasi. Mentre negli studi di interazione, la FP rileva solitamente un aumento del volume molecolare, nei saggi di dissociazione e di degradazione enzimatica la diminuzione del volume molecolare è tipicamente utilizzata come lettura.
Le principali applicazioni dei saggi di polarizzazione di fluorescenza in HTS sono l'analisi delle interazioni molecolari dirette e delle reazioni enzimatiche. In questo caso, i lettori di micropiastre veloci e sensibili consentono di effettuare uno screening efficiente di piccole molecole per una gamma crescente di classi di bersagli. Tra gli esempi, loscreening degli inibitori del regolatore dell'ubiquitinazione e del bersaglio antitumorale CSN5, nonché loscreening degli inibitori della H-Prostaglandina D Sintasi.
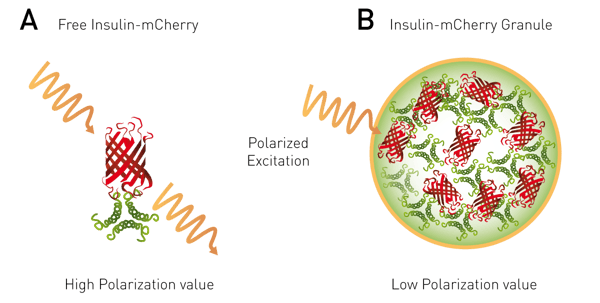
Il trasferimento di energia di risonanza di Förster (FRET) è un metodo comune per studiare gli eventi di interazione. In genere, i due partner dell'interazione sono marcati con due fluorofori diversi (donatore e accettore). La FRET, tuttavia, può avvenire anche tra fluorofori simili (homoFRET). La FP può essere applicata all'homoFRET, poiché il trasferimento di energia provoca una randomizzazione nella polarizzazione dell'emissione, producendo un segnale depolarizzato. L'omoFRET-FP può essere utilizzato per studiare l'accumulo di proteine o gli eventi di dimerizzazione in una cellula, come descritto nella nota applicativa "Monitoring of insulin granule packaging in live cells using homoFRET-FP detection" (fig. 6).
Il saggio immunologico a polarizzazione di fluorescenza (FPIA) è stato applicato per la prima volta in biochimica. Si tratta di un saggio biochimico competitivo utilizzato per rilevare antigeni o anticorpi. In un immunodosaggio a polarizzazione di fluorescenza, un antigene legato a un fluoroforo viene utilizzato come tracciante. Questo e un secondo antigene sono in genere in competizione per legare un anticorpo selezionato. Un elevato legame tra tracciante-anticorpo dà luogo a un segnale polarizzato, mentre se l'antigene non marcato è prevalentemente legato dall'anticorpo, il tracciante libero genererà una luce non polarizzata. Questa variazione è proporzionale alla quantità di antigene presente nel campione.8
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows