
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Le micropiastre sono disponibili in diversi colori, materiali, densità dei pozzetti e geometrie: scoprite qual è il formato più adatto alle vostre applicazioni.
Le micropiastre sono apparecchiature di laboratorio costituite da una piastra con più cavità (pozzetti) utilizzate come piccole provette per i campioni. Vengono anche chiamate piastre per microtitolazione o pozzetti multipli e sono generalmente disponibili nei formati a 6, 12, 24, 48, 96, 384 o 1536 pozzetti, con il layout a 96 pozzetti che è il più comunemente usato. A seconda delle dimensioni dei pozzetti, possono contenere volumi di campione da microlitri a millilitri.
Le micropiastre facilitano la preparazione, la manipolazione, l'esame, l'elaborazione e la gestione di molti campioni. Oggi sono uno standard nelle scienze biologiche e nella ricerca farmaceutica, nonché nella diagnostica clinica e nella ricerca analitica. I test di immunoassorbimento enzimatico (ELISA) sono una delle applicazioni più utilizzate. Tuttavia, gli usi sono diversi e diffusi nelle scienze biologiche, tra cui la conservazione dei campioni, la filtrazione, la separazione e la miscelazione, nonché il rilevamento e la quantificazione dei campioni.

Le micropiastre sono state create nel 1951 dal microbiologo ungherese Gyula Takátsy (fig. 1), quando un'epidemia di influenza causò una carenza di attrezzature di laboratorio. Takátsy aveva bisogno di trovare soluzioni poco costose per procedere con i suoi test clinici. Notò che i test erano troppo costosi in grandi lotti e che un aumento significativo della produttività poteva essere ottenuto posizionando più campioni uno accanto all'altro. Di conseguenza, creò la prima micropiastra mettendo insieme a mano 8 file di 12 pozzetti (8*12 = 96) e collegandoli con un anello di filo. Questa soluzione gli ha permesso di risparmiare tempo durante il pipettaggio.
Negli anni '60, la sua invenzione guadagnò gradualmente popolarità e fu adottata come apparecchiatura standard nei test biomedici dai laboratori di tutto il mondo.
L'uso diffuso è stato ulteriormente facilitato alla fine degli anni '80 dall'introduzione di una versione stampata. Ciò ha ridotto il prezzo per unità e aumentato la capacità di produzione. Negli anni successivi, le micropiastre sono state ulteriormente migliorate e sono state sviluppate diverse varianti per soddisfare le diverse esigenze della comunità scientifica.
Negli anni '90, la Society for Biomolecular Screening (SBS) iniziò un'opera di standardizzazione delle caratteristiche e delle forme. Le caratteristiche includevano principalmente il numero, la forma e la dimensione dei pozzetti, oltre a proprietà come le dimensioni generali e il materiale. Nel 2003, l'American National Standards Institute (ANSI) ha proposto e pubblicato una serie di caratteristiche standardizzate, che includevano il diametro, la profondità e la spaziatura dei pozzetti, nonché le dimensioni generali (ad esempio, 127,76 mm × 85,48 mm).1
La standardizzazione ha portato a un uso più ampio, a vantaggio soprattutto dell'automazione di laboratorio e della produzione di strumentazione di laboratorio. Di conseguenza, la micropiastra è cresciuta ulteriormente in popolarità come supporto efficace per la scoperta di farmaci e la ricerca sulle scienze della vita. Si stima che solo nel 2000 siano state utilizzate circa 125.000.000 di unità.2
Nel 2010, la SBS e l'Association for Laboratory Automation (ALA) si sono fuse per formare la Society for Laboratory Automation and Screening (SLAS). Da allora, gli standard per le micropiastre sono denominati ANSI/SLAS.
Oltre al numero di pozzetti, le micropiastre sono disponibili in diversi materiali e colori e comprendono forme e volumi diversi. Con un'ampia gamma di opzioni, a volte è difficile scegliere quella ottimale per un'analisi specifica. In questa sede, cercherò di riassumere le caratteristiche principali, mantenendo l'attenzione sulle applicazioni spettrofotometriche.
Sebbene esistano piccole differenze nelle dimensioni e nella posizione dei pozzetti per i diversi tipi di micropiastre dei vari produttori, tutte le piastre per microtitolazione hanno le stesse dimensioni di ingombro. I pozzetti sono solitamente disposti in una matrice rettangolare e sono disponibili nei formati da 6, 12, 24, 48, 96, 384 e 1536 pozzetti (fig. 2). È disponibile anche un layout a 3456 pozzetti, ma non è spesso utilizzato. Il volume di riempimento di ciascun pozzetto dipende dal layout. Il layout più utilizzato è quello a 96 pozzetti (fino a 300 µL/pozzetto). I layout a densità più elevata sono solitamente utilizzati per scopi di miniaturizzazione. Oltre a contenere un maggior numero di campioni, i formati a 384 pozzetti (fino a 100 µL/pozzetto), 1536 pozzetti (fino a 15 µL/pozzetto) e persino 3456 pozzetti (fino a 5 µL/pozzetto) riducono i volumi di reagenti e di conseguenza i costi (Tabella 1).
Il volume di riempimento di ciascun pozzetto dipende dal layout. Il layout più utilizzato è quello a 96 pozzetti (fino a 300 µL/pozzetto). I layout a densità più elevata sono solitamente utilizzati per scopi di miniaturizzazione. Oltre a contenere un maggior numero di campioni, i formati a 384 pozzetti (fino a 100 µL/pozzetto), 1536 pozzetti (fino a 15 µL/pozzetto) e persino 3456 pozzetti (fino a 5 µL/pozzetto) riducono i volumi di reagenti e di conseguenza i costi (Tabella 1).
Come regola generale, un terzo del volume massimo di riempimento è il volume minimo consigliato per un pozzetto per avere una misurazione efficiente e realistica. Pertanto, non si dovrebbe scendere al di sotto di 100 µL per una piastra microtiter standard a 96 pozzetti.
Le micropiastre a 96 pozzetti a metà area (fino a 170 µL/pozzetto) sono soluzioni intermedie. Queste micropiastre hanno essenzialmente la stessa dimensione dei pozzetti della piastra da 384 pozzetti, pur mantenendo le dimensioni esterne e la posizione dei pozzetti di una piastra da 96 pozzetti. Di conseguenza, i pozzetti sono più piccoli e consentono una riduzione del volume di campione fino al 50%. Questo formato è tipicamente utilizzato come alternativa ai 384 pozzetti quando sono richiesti bassi volumi ma non sono necessarie automazione e produttività.
Un concetto simile si applica ai layout a 384 pozzetti in formato a basso o piccolo volume (a volte indicato anche come "base alta"). Queste piastre hanno le stesse dimensioni dei pozzetti di una piastra da 1536 pozzetti con le dimensioni esterne e le posizioni dei pozzetti di una piastra da 384 pozzetti. Allo stesso modo, i volumi dei campioni possono essere ridotti di oltre il 50% rispetto a una piastra standard da 384 pozzetti. Oltre al volume, anche la forma dei pozzetti è influenzata: mentre i normali layout a 384 pozzetti hanno pozzetti di forma quadrata, quelli a basso volume hanno pozzetti rotondi.
Tabella 1: Confronto tra le diverse capacità di volume di riempimento dei vari layout.
| Numero di pozzi | Volume consigliato |
| 6 | 2-5 mL |
| 12 | 2-4 mL |
| 24 | 0,5-3 ml |
| 48 | 0,5-1,5 ml |
| 96 | 100-300 µL |
| 96 metà area | 50-170 µL |
| 384 | 30-100 µL |
| 384 basso/piccolo volume | 5-25 µL |
| 1536 | 5-25 µL |
| 3456 | 1-5 µL |
In generale, i formati a densità più elevata (ad esempio, 1536 e 3456 pozzetti) non possono essere pipettati a mano ed è necessaria una macchina pipettatrice. Il pipettaggio manuale è ancora possibile nei 384 pozzetti, ma è noioso e solitamente sconsigliato. Di conseguenza, è necessario valutare se i maggiori costi di manipolazione associati alla lavorazione di micropiastre da 1536 o 3456 pozzetti siano controbilanciati dai risparmi ottenuti grazie alla miniaturizzazione. Questo è tipicamente il caso delle strutture di screening ad alta produttività, ma non della maggior parte dei laboratori di scienze biologiche.
Le piastre per ELISA sono in genere dotate di 96 pozzetti e consistono in dodici strisce separate da otto pozzetti (fig. 3). Questa architettura semplifica l'uso e la manipolazione parziale.
Le piastre per microtitolazione possono essere prodotte con diversi materiali. I più comunemente utilizzati sono i polimeri policarbonato, polistirene e cicloolefina. La scelta del polimero influisce sulla trasmissione della luce, sull'autofluorescenza, sull'assorbimento dell'acqua e sullo scambio di gas, influenzando di conseguenza l'uso, le applicazioni e la qualità del saggio.
In genere, il materiale più utilizzato per le attrezzature da laboratorio in plastica è il polistirene. La sua trasparenza lo rende ideale per la rilevazione ottica, i saggi di assorbanza (come l'ELISA) e la microscopia con modifiche moderate. Tuttavia, il polistirene non trasmette la luce UV (< 320 nm) ed è quindi inadeguato per la quantificazione di RNA e DNA. A questo scopo, il copolimero ciclicolene (COC) è dotato di una migliore trasmissione della luce ultravioletta nell'intervallo 200-400 nm e di una bassa autofluorescenza (fig. 4).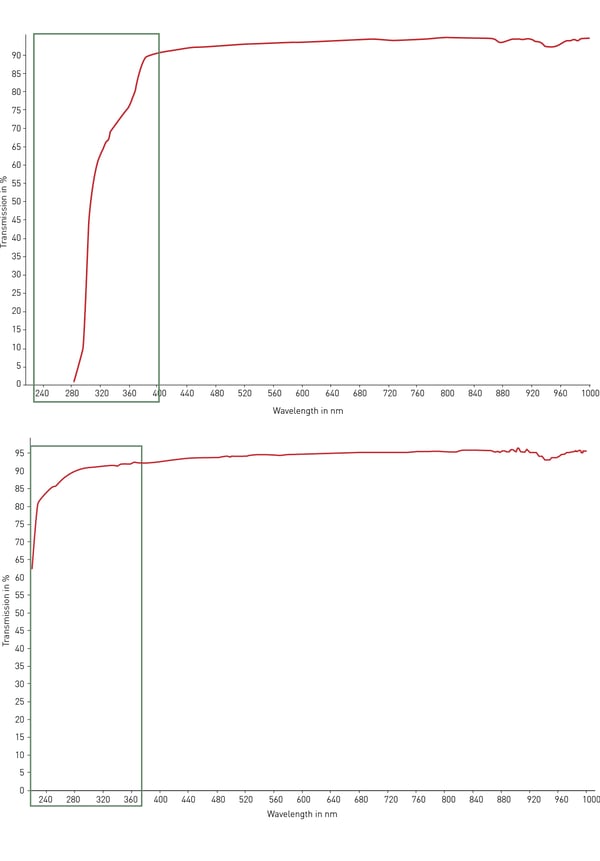 Per le applicazioni ottiche e di microscopia e per lo screening ad alto contenuto, il vetro e il quarzo sono i migliori materiali possibili per trasparenza, autofluorescenza e trasmissione della luce. Tuttavia, questi materiali sono molto costosi, fragili e solitamente non sono monouso.
Per le applicazioni ottiche e di microscopia e per lo screening ad alto contenuto, il vetro e il quarzo sono i migliori materiali possibili per trasparenza, autofluorescenza e trasmissione della luce. Tuttavia, questi materiali sono molto costosi, fragili e solitamente non sono monouso.
Oltre alle proprietà ottiche, l'assorbimento dell'acqua e lo scambio di gas giocano un ruolo importante per le applicazioni cellulari. Inoltre, le proprietà meccaniche influiscono sulla manipolazione, soprattutto da parte di sistemi automatizzati. Le proprietà termiche possono svolgere un ruolo importante nelle applicazioni ad alta temperatura (ad esempio, piastre PCR) o quando sono necessari sigillanti.
Il policarbonato e il polipropilene sono utilizzati principalmente per le piastre PCR (fig. 5) e per i campioni soggetti a forti sbalzi di temperatura (ad esempio, conservazione a -80°C). Oltre alla stabilità alla temperatura, per la conservazione sono richieste anche la resistenza a numerosi solventi e l'inerzia biologica.
Le micropiastre sono generalmente disponibili in quattro colori: trasparente, nero, bianco e grigio (fig. 6). A seconda della modalità di rilevamento utilizzata, il colore può influenzare il rapporto segnale-sfondo e il cross-talk pozzetto-pozzetto quando campioni molto luminosi e poco luminosi sono adiacenti. Di conseguenza, una scelta di colore non ottimale può avere un impatto negativo sui dati.
 Le micropiastre trasparenti (comprese quelle trasparenti ai raggi UV) sono necessarie per i saggi di assorbanza, poiché in questa modalità di rilevamento la luce deve passare attraverso il campione.
Le micropiastre trasparenti (comprese quelle trasparenti ai raggi UV) sono necessarie per i saggi di assorbanza, poiché in questa modalità di rilevamento la luce deve passare attraverso il campione.
Le micropiastre nere (che sono scurite dalla presenza di carbonio) spengono parzialmente il segnale del campione. Questo avviene perché il colore nero assorbe parzialmente il segnale luminoso proveniente dal campione. Di conseguenza, queste piastre sono adatte per l'intensità della fluorescenza, compresa la FRET, e per i saggi di polarizzazione della fluorescenza. Si tratta in genere di modalità di rilevazione con una forte resa del segnale e l'uso del colore nero aiuta a ridurre lo sfondo, l'autofluorescenza e il cross-talk pozzetto-pozzetto, fornendo un migliore rapporto segnale-blocco.
Le micropiastre nere sono generalmente sconsigliate per i saggi di luminescenza, fluorescenza risolta nel tempo (TRF) e TR-FRET, poiché queste modalità di rivelazione hanno solitamente una resa del segnale relativamente bassa, che verrebbe ulteriormente attenuata dal colore nero. Per queste analisi si consigliano piastre bianche, che includono biossido di titanio. Il colore bianco del pozzetto riflette parzialmente il segnale del campione, contribuendo a massimizzarlo. Lo svantaggio è che le micropiastre bianche aumentano anche il segnale del bianco. Tuttavia, questo è di solito piuttosto basso nei dosaggi luminescenti. Nella TRF, la finestra di misurazione ritardata elimina l'influenza dello sfondo.
Una soluzione intermedia tra il nero e il bianco sono le micropiastre grigie. Queste sono specificamente raccomandate per AlphaScreen® e AlphaLISA® in quanto riducono il cross-talk e lo sfondo pur fornendo buoni segnali.
Se desiderate maggiori dettagli sull'influenza del colore delle piastre sui risultati delle misurazioni in diverse modalità di rilevamento e volete vedere i dati che ne dimostrano gli effetti, visitate la nota HowTo 6: Come scegliere il miglior colore di micropiastra per il mio saggio
I pozzetti possono essere circolari o quadrati e questi ultimi possono avere angoli dritti o arrotondati. I pozzetti quadrati contengono un volume di campione maggiore e aumentano l'area di trasmissione della luce rispetto ai pozzetti rotondi. I pozzetti rotondi hanno un'area totale più piccola e sono più adatti all'agitazione. Inoltre, poiché i pozzetti rotondi normalmente non condividono una parete comune con i pozzetti adiacenti, sono meno influenzati rispetto a quelli quadrati dal cross-talk del segnale attraverso la parete di plastica del pozzetto.
Anche i fondi dei pozzetti sono disponibili in diverse forme: Fondo a F, a V, a U e a C (fig. 7). I pozzetti con fondo F (piatto) offrono la migliore trasmissione della luce, sono ideali per le colture cellulari aderenti e sono adatti per i saggi di lettura del fondo con lettori di piastre o microscopi.
I pozzetti con fondo a V (conici) consentono di prelevare il massimo volume di campioni piccoli e preziosi grazie alla loro forma. Tuttavia, la forma conica è svantaggiosa per le applicazioni spettrofotometriche o di imaging. Di conseguenza, i pozzetti a forma di V sono utilizzati principalmente per la conservazione dei campioni e il pipettaggio preciso.
Il fondo arrotondato dei pozzetti (fondo a U) facilita la miscelazione, il lavaggio e il rivestimento. I pozzetti con fondo a U consentono un pipettaggio facile e senza residui e sono tipicamente utilizzati per cellule in sospensione e sferoidi.
I pozzetti a fondo curvo (fondo C) sono un compromesso tra i pozzetti a fondo F e quelli a fondo U. Il fondo piatto li rende adatti alle misure ottiche, mentre i bordi arrotondati facilitano la miscelazione e il lavaggio.

Le proprietà superficiali del pozzetto svolgono un ruolo importante. Qui il campione e il materiale del pozzetto interagiscono tra loro. In genere, sono disponibili tre tipi principali di micropiastre: non leganti o a basso legame, a medio e ad alto legame. Il legame è influenzato dalle proprietà fisiche del materiale e può essere modificato applicando diversi rivestimenti.
Per le applicazioni di spettroscopia biochimica e di screening ad alto rendimento, il polistirene senza rivestimento è il materiale preferito e viene classificato come a medio legame.
Le piastre non leganti impediscono il legame di acidi nucleici, proteine e peptidi alla superficie del pozzetto. In questo caso, un rivestimento specifico riduce il background del saggio e migliora il rapporto segnale/rumore.
Le micropiastre ad alto legame sono tipicamente utilizzate per i test che richiedono l'immobilizzazione delle molecole sulla superficie del pozzetto. Uno degli usi più noti sono i saggi ELISA. In questo caso, rivestimenti e trattamenti specifici introducono un numero definito di gruppi idrofili per facilitare l'adsorbimento passivo di biomolecole (ad esempio, anticorpi). Le piastre a medio e alto legame differiscono tipicamente per il numero di gruppi polari disponibili.
Un esempio di come il rivestimento delle piastre possa influenzare i dati biologici è stato mostrato attraverso un test sull'attività del proteasoma eseguito con piastre non leganti, a medio e ad alto legame. In questo studio, i ricercatori hanno ottenuto risultati diversi e hanno dimostrato che le prestazioni del saggio del proteasoma sono influenzate dalle proprietà delle micropiastre. L'attività del proteasoma è stata determinata con un substrato fluorescente del proteasoma, la 7-amino-4-metilcumarina (AMC), un'etichetta ampiamente utilizzata a questo scopo. Poiché gli spettri di eccitazione ed emissione dell'AMC legato e non legato sono diversi, è stato possibile rilevare facilmente l'AMC libero rilasciato dalla scissione proteolitica con un lettore di piastre a fluorescenza. Tuttavia, le curve standard di AMC libera hanno mostrato differenze significative tra i tre tipi di piastra. Come previsto, la piastra ad alto legame ha dato il segnale più basso. È quindi necessario valutare diverse micropiastre per determinare la migliore per il test e il ruolo di eventuali effetti specifici della piastra.4
Un diverso rivestimento della piastra può anche avere un'influenza sostanziale sulla formazione di menischi sulla superficie del liquido, che possono avere un impatto sostanziale sulle misurazioni basate sull'assorbanza a causa di una modifica della lunghezza del percorso, come spiegato nella nota HowTo: How to deal with path length and meniscus in microplates.
Le piastre normali non possono essere utilizzate per la coltura cellulare e per i saggi basati sulle cellule, poiché in genere non sono sterili. Oltre alla sterilità, sono necessari trattamenti specifici della superficie idrofila per facilitare l'attaccamento delle cellule al fondo del pozzetto. Tali trattamenti idrofili sono solitamente definiti "trattati per coltura tissutale" o TC. Esistono anche rivestimenti a base di proteine della matrice extracellulare come collagene, fibronectina e laminina, nonché rivestimenti sintetici come le polilisine. Per le cellule in sospensione, gli organoidi e gli sferoidi è tipicamente richiesta una superficie repellente per le cellule.
Poiché i saggi cellulari vengono talvolta valutati per diverse ore o giorni, l'evaporazione dai pozzetti contenenti le cellule può potenzialmente influenzare i risultati e, in ultima analisi, portare a una riduzione della vitalità cellulare. Alcuni produttori offrono piastre con un fossato esterno che può essere riempito di liquido. Questo aiuta a isolare i pozzetti, impedendo così l'evaporazione, soprattutto dai pozzetti del bordo che presentano un rischio di evaporazione.
Quando si eseguono saggi a base di cellule, la rilevazione dal fondo del pozzetto è solitamente consigliata per diversi motivi. Nelle normali piastre bianche o nere, la lettura dal fondo del pozzetto non è possibile e occorre utilizzare fondi trasparenti. Le pareti dei pozzetti possono essere bianche o nere a seconda del dosaggio. Il fondo trasparente può essere realizzato in diversi materiali, dalla plastica (polistirene o copolimero ciclico) al vetro o al quarzo. Sebbene il rilevamento sia significativamente migliore con il vetro e ancor più con il quarzo rispetto alla plastica, questi materiali sono anche molto più costosi. Inoltre, le piastre di vetro e quarzo non sono monouso e devono essere pulite e sterilizzate in autoclave dopo ogni utilizzo. Pertanto, è necessario decidere se le migliori prestazioni, a fronte di un costo più elevato e di una maggiore manutenzione, giustifichino l'uso di una piastra di questo tipo rispetto a una micropiastra monouso più economica e facile da usare con fondo in plastica trasparente.
I lettori di micropiastre rilevano e quantificano i segnali luminosi prodotti da campioni liquidi in saggi basati su micropiastre. Questi strumenti di laboratorio sono utilizzati nelle scienze biologiche e nell'industria farmaceutica per quantificare reazioni chimiche, biologiche o fisiche. Oltre alle applicazioni biologiche, cellulari, biochimiche, farmaceutiche e di scoperta di farmaci, i lettori di micropiastre sono utilizzati anche nella ricerca ambientale e nell'industria alimentare o cosmetica.
I lettori di micropiastre sono disponibili come strumenti a modalità singola o multipla, in grado di quantificare i campioni in diverse modalità, come assorbanza, intensità di fluorescenza, luminescenza, fluorescenza risolta nel tempo, TR-FRET, polarizzazione di fluorescenza e AlphaScreen. A seconda del metodo di selezione delle lunghezze d'onda, i lettori di piastre possono essere monocromatici o a filtro.
Il loro utilizzo migliora tipicamente l'efficienza delle pratiche di laboratorio e aiuta a risparmiare sui costi dei reagenti e a ridurre i tempi operativi. Per una panoramica su come vengono utilizzati oggi i lettori di micropiastre, consultate il nostro database di note applicative.
Nonostante gli standard ANSI/SLAS, le piastre di diversi produttori presentano leggere variazioni nelle dimensioni e nella posizione dei pozzetti. Ciò può influenzare i dati misurati. Anche un piccolo scostamento nella profondità o nella larghezza della posizione dei pozzetti su una linea con 24 o 48 pozzetti (per una piastra da 384 e 1536 pozzetti, rispettivamente) può far sì che le misurazioni non vengano più effettuate al centro del pozzetto ma, nel peggiore dei casi, sulla parete di plastica tra due campioni.
Per questo motivo, i lettori BMG LABTECH sono dotati di un database di selezione delle micropiastre che comprende oltre 50 diversi layout di piastre di diversi produttori.
Oltre ai lettori di micropiastre, esistono altri strumenti che trattano o gestiscono le micropiastre. Questi strumenti sono utilizzati specificamente nell'automazione di laboratorio. Alcuni esempi sono i manipolatori di liquidi e i lavatori utilizzati per dispensare o rimuovere i liquidi da e verso le diverse piastre, i bracci robotici e i nastri trasportatori per trasportare le piastre tra gli strumenti, gli impilatori di piastre per conservarle per brevi periodi e gli hotel per piastre o gli incubatori per la conservazione a lungo termine. Inoltre, i sigillatori e i de-sigillatori di piastre applicano e rimuovono le pellicole sigillanti. Un esempio di movimentazione automatizzata è visibile nel seguente video:

Nel complesso, i lettori multimodali BMG LABTECH combinano prestazioni con analisi miniaturizzate, compatibilità con le opzioni di gestione automatizzata, tempi di misurazione ridotti e consentono di risparmiare sui materiali e su altre risorse.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series