
NEPHELOstar Plus
Microplate nephelometer for light-scattering and turbidity measurements


Explorez la néphélométrie pour des mesures précises de la turbidité dans les tests en solution. Découvrez comment les lecteurs de microplaques améliorent la sensibilité pour les applications dans la formulation des ...
Il s'agit d'une technique de chimie analytique utilisée pour mesurer la turbidité ou l'opacité d'une solution causée par la présence de particules insolubles en suspension.
Lorsqu'elle est dirigée à travers une solution opaque contenant des particules solides en suspension, la lumière est transmise, absorbée et diffusée par les particules (voir la figure 1). La quantité de lumière diffusée dépend de la taille, de la forme et de la concentration des particules insolubles dans la solution ainsi que de la longueur d'onde de la lumière incidente.
Les théories et les concepts sur la diffusion de la lumière ont été élaborés à la fin du 19e et au début du 20e siècle, principalement par Rayleigh, Mie et Debye.
La néphélométrie a d'abord été appliquée dans le domaine de la chimie clinique pour les immunodosages, afin de détecter et de quantifier les protéines sériques dans le sang, telles que les immunoglobulines et les macromolécules. Ces applications sont encore utilisées de nos jours. Appliquées aux lecteurs de microplaques, elles sont principalement utilisées pour analyser la précipitation de matériaux, comme la solubilité des médicaments et l'agrégation des protéines, ou la croissance bactérienne (voir la figure 2).
La turbidité, ou trouble, peut être détectée par néphélométrie ou par turbidimétrie. Ces deux techniques non destructives sont basées sur la diffusion de la lumière causée par une suspension de particules solides. Bien que ces deux termes soient parfois utilisés comme synonymes, ils ne le sont pas d'un point de vue technique. La turbidimétrie consiste à mesurer la perte d'intensité de la lumière transmise à travers un échantillon, due à l'effet de diffusion des particules insolubles. Comme l'absorbance, la turbidimétrie quantifie l'intensité de la lumière transmise à travers l'échantillon, en particulier son atténuation. En turbidimétrie, la lumière d'une longueur d'onde connue traverse un échantillon contenant des particules insolubles en solution. Un détecteur placé en ligne avec la source lumineuse recueille la lumière qui traverse l'échantillon (voir la figure 3A). La diminution de la transmission de la lumière est mesurée par rapport à une référence, et la lumière absorbée est quantifiée en unités de densité optique (DO).2 En conséquence, la turbidité peut être mesurée à l'aide d'un lecteur de microplaques d'absorbance, par exemple.
En revanche, la néphélométrie détermine la turbidité d'une solution en quantifiant directement l'intensité de la lumière diffusée par les particules insolubles de l'échantillon. En général, la lumière diffusée est mesurée à un angle par rapport à la source de lumière incidente afin d'éviter les interférences de la lumière transmise (voir la figure 3B). À cet égard, elle présente des similitudes avec la mesure de l'intensité de la fluorescence.
Lors de la réalisation de tests de diffusion de la lumière, le choix entre la néphélométrie et la turbidimétrie est principalement dicté par deux facteurs.
La néphélométrie est donc la technique la mieux adaptée pour l'analyse des petites particules en suspension à de faibles concentrations, car elle offre une plus grande sensibilité. La turbidimétrie est généralement utilisée pour analyser des particules insolubles relativement grandes et présentes en grande quantité. Elle est notamment utilisée en biologie pour déterminer le nombre de cellules (par exemple, de bactéries) dans une solution.3
La diffusion de la lumière dans les liquides suit les règles de la diffusion élastique de la physique des particules, dans laquelle aucune énergie n'est absorbée par l'une ou l'autre des particules lors de la « collision ». L'énergie d'un photon avant et après l'événement de diffusion reste inchangée. La diffusion élastique est différente pour les petites et les grandes particules. Pour les grosses particules, la lumière est principalement diffusée dans la direction avant (angle avant). Lorsque la taille des particules est inférieure à 5 % de la longueur d'onde de la lumière qui les frappe, la diffusion est symétrique.4
Les molécules solubles sont généralement de petite taille par rapport aux longueurs d'onde de la lumière incidente et se diffusent de manière presque symétrique (voir la figure 4A). En revanche, les précipités et les complexes en solution sont généralement plus grands (plus proches des longueurs d'onde de la lumière incidente) et produisent principalement une diffusion à angle droit (voir la figure 4B). La détection néphélométrique se concentre généralement sur la mesure de la diffusion vers l'avant.
L'intensité de la lumière diffusée (IS) et la concentration du précipité (C) sont liées par l'équation suivante :
IS=kS*I0* C
KS est une constante déterminée à partir d'un étalonnage du système et I₀ est l'intensité à la source lumineuse.
Les propriétés physiques d'une suspension de particules dépendent de plusieurs variables. Bien que la diffusion soit liée à la concentration de particules solides en solution, l'intensité de la lumière diffusée dépend également de leur taille et de leur forme. Des échantillons concentrés contenant des précipités de tailles différentes présenteront donc des niveaux de diffusion différents.
De plus, la taille et la forme des précipités dépendent de la température, du pH, de la concentration des réactifs, de l'ordre de mélange, de l'agitation et de l'intervalle de temps entre la formation du précipité et la détection. Pour obtenir des conditions et des résultats reproductibles entre les échantillons et les essais, il est nécessaire de prendre en compte toutes ces variables.4,5
La sélection de la longueur d'onde n'est généralement pas pertinente, car l'absorption de la lumière incidente par les particules en suspension n'est pas prise en compte, à condition qu'elle n'induise pas la fluorescence de l'échantillon. Par conséquent, si des échantillons non fluorescents sont utilisés, il n'est pas nécessaire de sélectionner la longueur d'onde. Le choix de la longueur d'onde est principalement basé sur la nécessité de minimiser les interférences potentielles et n'affecte pas l'intensité de la lumière incidente ou de la diffusion.4
Bien que les fluoromètres puissent être utilisés pour la détection néphélométrique, la dépendance angulaire de la diffusion a encouragé le développement d'appareils spécifiques. Les turbidimètres dont les détecteurs sont placés à un angle par rapport au faisceau incident sont appelés néphélomètres. Ils sont considérés comme l'instrument standard pour la mesure des faibles valeurs de turbidité. Ils mesurent l'intensité de la lumière diffusée. La lumière transmise n'est pas détectée.
Les composants de base de cet appareil comprennent une source de lumière, une optique de diffusion de la lumière et un détecteur. La source lumineuse génère un faisceau qui traverse l'échantillon. Des lampes halogènes ou au xénon, ainsi que des lasers, peuvent être utilisés comme sources lumineuses. Les lasers sont généralement le choix le plus courant en raison de leur sensibilité, de leur intensité élevée et de leur nature cohérente (les photons émis sont « en phase » les uns avec les autres). Les longueurs d'onde entrantes et sortantes sont identiques et ne sont donc pas sélectionnées optiquement.
Un détecteur est placé face à la source lumineuse, à un certain angle par rapport au faisceau entrant. Il détecte les variations de la diffusion vers l'avant ou de la diffusion latérale, en fonction de sa position. Selon l'angle sous lequel la majeure partie de la diffusion peut être recueillie, les détecteurs peuvent être placés à des angles de 30°, 70° ou 90°.
La néphélométrie peut être effectuée comme point final ou comme mesure cinétique. Les mesures de point final quantifient la diffusion maximale de la lumière après qu'une réaction a atteint l'équilibre ou à un moment prédéterminé. La détection cinétique (lectures multiples dans le temps) peut être appliquée tout au long du processus de précipitation et fournit généralement davantage d'informations sur la réaction.
Depuis les années 1970, l'immunonéphélométrie est utilisée dans les laboratoires cliniques pour analyser les immunodosages. À l'origine, elle servait à détecter la formation et la précipitation de complexes immuns (antigène-anticorps), une application qui est encore utilisée aujourd'hui. Elle est également utilisée pour déterminer la concentration des protéines sériques, y compris des immunoglobulines, ainsi que dans les coagulomètres automatisés à haut débit. Ces appareils quantifient les facteurs de coagulation dans les échantillons sanguins et permettent d'établir des profils de coagulation à partir de plusieurs essais.
Dans les laboratoires pharmaceutiques, la néphélométrie est principalement utilisée pour évaluer la solubilité des médicaments ou des composés. Il s'agit également d'une méthode prometteuse pour quantifier la croissance microbienne, et elle est couramment utilisée pour déterminer le nombre de cellules dans les suspensions de micro-organismes tels que la levure (par exemple, S. cerevisiae).6
La néphélométrie peut également être détectée dans des microplaques (voir la figure 5). Ce format est particulièrement avantageux pour les laboratoires de sciences de la vie et l'industrie pharmaceutique, car la manipulation des échantillons et des composés en microplaques permet d'augmenter l'efficacité et le rendement. Les néphélomètres en microplaques offrent généralement un rendement plus élevé, une approche simplifiée et un faible volume pour la collecte de données sur la turbidité. Le premier dispositif de détection néphélométrique en microplaques basé sur un laser, le NEPHELOstarPlus, a été développé par BMG LABTECH. Cet instrument détecte les particules en solution dans un puits de microplaque en mesurant la lumière diffusée à angle droit générée lorsque le faisceau laser traverse l'échantillon.
Le premier dispositif de détection néphélométrique en microplaques basé sur un laser, le NEPHELOstarPlus, a été développé par BMG LABTECH. Cet instrument détecte les particules en solution dans un puits de microplaque en mesurant la lumière diffusée à angle droit générée lorsque le faisceau laser traverse l'échantillon.
Une diode laser hautement collimatée sert de source lumineuse et permet de régler l'intensité et le diamètre du faisceau. Ces caractéristiques réduisent les problèmes de ménisque et optimisent la sensibilité, permettant ainsi d'effectuer des mesures dans des microplaques de 384 puits.
Dans le NEPHELOstar Plus, le faisceau laser traverse le puits d'échantillon et pénètre dans une sphère d'Ulbricht (ou sphère d'intégration) placée sous la microplaque. Cette sphère recueille la lumière diffusée incidente en tout point de sa surface intérieure et la distribue également à tous les autres points par des réflexions multiples. La sphère d'Ulbricht recueille la lumière diffusée jusqu'à un angle de 80°, préserve son intensité, mais minimise les angles de diffusion originaux, éliminant ainsi l'information spatiale et produisant une lumière diffuse qui peut être quantifiée par le détecteur (voir la figure 6).
Si le faisceau lumineux n'est pas dévié par les précipités présents dans le puits, il traverse directement la sphère d'Ulbricht ; il n'y a alors pas de réflexion et aucun signal n'atteint le détecteur. En revanche, si des particules sont présentes dans l'échantillon, la lumière est diffusée et réfléchie à l'intérieur de la sphère d'Ulbricht, puis mesurée par un détecteur positionné à 90° par rapport à la lumière incidente (voir la figure 7).
La turbidité est souvent exprimée en unités de turbidité néphélométrique (UTN), notamment dans les tests de qualité de l'eau. Les valeurs UTN peuvent être dérivées à partir d'un instrument calibré sur la base de mesures comparatives avec des suspensions de formazine de référence. Il s'agit toutefois d'un processus long et en plusieurs étapes qui nécessite de grands volumes d'échantillons. Le NEPHELOstar Plus quantifie les résultats en unités néphélométriques relatives (UNR). La façon dont les UTN peuvent être comparées aux UNR est décrite dans la publication : « Improving throughput for assessing nephelometric turbidity units (NTUs) using the NEPHELOstar Plus ». La corrélation entre les deux approches est illustrée à la figure 8.
Les tests néphélométriques sont généralement réalisés dans des microplaques de 96 ou 384 puits. La qualité optique de ces microplaques est un aspect extrêmement important. Les imperfections telles que la poussière, la saleté, les empreintes digitales ou les rayures sur le fond des puits peuvent en effet disperser la lumière, générant ainsi des signaux faussement positifs, réduisant la fenêtre du test ou entraînant une réduction significative de la sensibilité. Par conséquent, les puits présentant des valeurs particulièrement élevées ou supérieures à la moyenne du blanc plus deux écarts-types ne doivent généralement pas être pris en compte.
La néphélométrie en microplaques est un outil inestimable pour l'industrie pharmaceutique, car elle permet de réaliser des criblages de solubilité de composés à haut débit. Elle peut également être utilisée pour la croissance microbienne, la cinétique de liaison des protéines, la mesure de la propension à la calcification dans les fluides corporels, la détection des facteurs rhumatoïdes dans le sérum ou encore la liaison antigène-anticorps (voir la figure 9).
 Les test de solubilité des médicaments
Les test de solubilité des médicamentsDans l'industrie pharmaceutique, le criblage à haut débit est une méthode importante pour découvrir de nouveaux médicaments. L'évaluation de la solubilité est une étape obligatoire de ce processus, car elle permet de déterminer la validité des résultats pharmacologiques et de sélectionner les composés les plus prometteurs. La solubilité des médicaments a un impact majeur sur leur disponibilité, leur formulation, leur dosage et leur absorption. Il est donc essentiel de l'analyser dès le début du processus de découverte d'un médicament afin d'éviter les criblages ADME coûteux en temps et en argent concernant des composés peu solubles.
Traditionnellement, les tests de solubilité à l'équilibre sont réalisés avec un débit limité : le composé est agité et incubé avec un solvant pendant au moins 24 heures, puis filtré et la concentration est déterminée par HPLC. Cette approche ne répond plus aux exigences de la recherche moderne de médicaments.
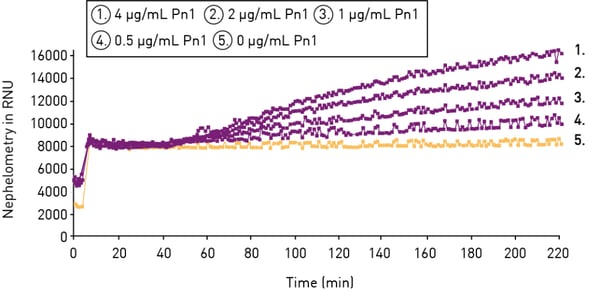
Aujourd'hui, les cribles cinétiques de solubilité automatisés, réalisés sur des néphélomètres à microplaques, permettent d'obtenir un débit plus élevé en moins de temps. Dans cette approche, une série de dilutions du composé à tester est préparée dans une solution aqueuse, puis pipettée dans une microplaque. Le précipité non dissous est détecté par diffusion de la lumière. À des concentrations élevées, le composé précipite, ce qui rend la suspension trouble et entraîne un nombre élevé d'UNR. Tant que la concentration est supérieure à la solubilité, le composé précipite. Lorsque la concentration est inférieure à la solubilité, le composé se dissout complètement, ce qui donne une solution claire. En conséquence, la dispersion et le nombre d'UNR seront considérablement réduits. Généralement, deux ajustements linéaires sont appliqués aux données pour les phases soluble et insoluble. Le point où ils se croisent est considéré comme le point de solubilité cinétique (voir la figure 10).
Les avantages de cette approche sont la rapidité du test et la facilité de manipulation. Les tests néphélométriques en microplaques ne nécessitent que des étapes de pipetage ; il n'est pas nécessaire de filtrer ou de séparer la phase de la solution du résidu non dissous. De plus, aucune étape de transfert de liquide n'est nécessaire, car la préparation du test et sa mesure peuvent être effectuées dans la même microplaque. Enfin, cette méthode permet de déterminer à la fois la concentration à laquelle un composé devient soluble et le point de précipitation d'un soluté.
En général, le signal détecté est linéaire jusqu'à trois ordres de grandeur de la concentration de particules, et une limite de détection d'environ 20 mmol/L peut être atteinte pour les tests de solubilité cinétique.8
La néphélométrie en microplaques peut également servir de détection de la croissance microbienne par l'DO600 basée sur l'absorbance. À mesure que les bactéries se multiplient, le nombre de cellules fluctuant dans la solution augmente, ce qui accroît les niveaux de diffusion et le nombre d'UNR. Une dilution en série de la culture est généralement utilisée pour établir une relation entre la densité optique et le nombre d'UNR. L'approche néphélométrique est comparable à l'approche basée sur l'absorbance, mais elle est généralement plus sensible.
Les publications : « Monitoring of microbial growth curves by laser nephelometry » et « Nephelometric monitoring growth of Candida albicans » (fig.11) montrent comment les courbes de croissance peuvent être mesurées efficacement sur le NEPHELOstarPlus.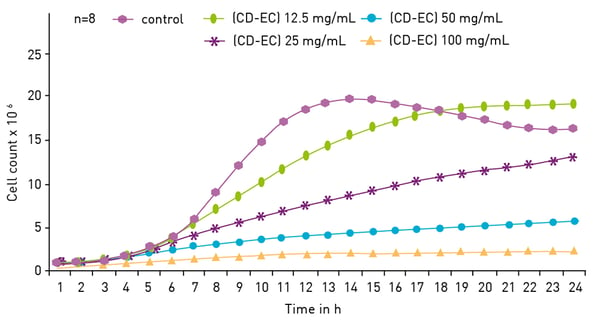
Cette technique polyvalente permet de gagner du temps dans les laboratoires de recherche. Elle est notamment utilisée pour étudier les réponses immunitaires, les mécanismes immunitaires ou les événements immunitaires. De nombreuses applications sont centrées sur la quantification des protéines.
Microplate nephelometer for light-scattering and turbidity measurements