
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Las microplacas están disponibles en distintos colores, materiales, densidades de pocillos y geometrías. Explore qué formato se adapta mejor a sus aplicaciones.
Las microplacas son dispositivos de laboratorio que consisten en una placa con múltiples cavidades (pocillos) que se utilizan como pequeños tubos de muestras. También se denominan placas de microtitulación o multipocillos y suelen tener formatos de 6, 12, 24, 48, 96, 384 o 1536 pocillos, siendo el de 96 el más utilizado. Según el tamaño de los pocillos, pueden contener volúmenes de muestra de microlitros a mililitros.
Las microplacas facilitan la preparación, manipulación, examen, procesamiento y gestión de numerosas muestras. Hoy en día, son un estándar en las ciencias de la vida y la investigación farmacéutica, así como en el diagnóstico clínico y la investigación analítica. Los ensayos inmunoenzimáticos (ELISA) son una de las aplicaciones más utilizadas. Sin embargo, sus usos son diversos y están muy extendidos en las ciencias de la vida, incluyendo el almacenamiento, filtración, separación y mezcla de muestras, así como la detección y cuantificación de las mismas.

Las microplacas fueron creadas en 1951 por el microbiólogo húngaro Dr. Gyula Takátsy (fig.1), cuando una epidemia de gripe provocó una escasez de material de laboratorio. Takátsy necesitaba encontrar soluciones baratas para llevar a cabo sus ensayos clínicos. Se dio cuenta de que las pruebas eran demasiado caras en grandes lotes y que se podía conseguir un aumento significativo de la capacidad de procesamiento colocando varias muestras una junto a otra. En consecuencia, creó la primera microplaca juntando a mano 8 filas de 12 pocillos (8*12 = 96) y uniéndolas con un lazo de alambre. Esta solución le permitió ahorrar tiempo al pipetear.
En la década de 1960, su invento fue ganando popularidad y los laboratorios de todo el mundo lo adoptaron como equipo estándar en las pruebas biomédicas.
Su uso generalizado se vio facilitado a finales de la década de 1980 con la introducción de una versión moldeada. Esto redujo el precio por unidad y aumentó la capacidad de producción. En los años siguientes se siguieron mejorando las microplacas y se desarrollaron múltiples variantes para adaptarse a las distintas necesidades de la comunidad científica.
En la década de 1990, la Society for Biomolecular Screening (SBS) inició un esfuerzo por estandarizar las características y las formas. Las características incluían principalmente el número, la forma y la dimensión de los pocillos, así como propiedades como las dimensiones generales y el material. En 2003, el American National Standards Institute (ANSI) propuso y publicó un conjunto de características normalizadas, que incluían el diámetro, la profundidad y el espaciado de los pocillos, así como las dimensiones generales (es decir, 127,76 mm × 85,48 mm).1
La normalización condujo a un uso más amplio, que benefició especialmente a la automatización de los laboratorios y a la producción de instrumentos de laboratorio. En consecuencia, la microplaca fue ganando popularidad como soporte eficaz para el descubrimiento de fármacos y la investigación en ciencias de la vida. Se calcula que sólo en el año 2000 se utilizaron unos 125.000.000 de unidades.2
En 2010, la SBS y la Association for Laboratory Automation (ALA) se fusionaron para formar la Society for Laboratory Automation and Screening (SLAS). Desde entonces, las normas para microplacas se denominan ANSI/SLAS.
Además del número de pocillos, las microplacas están disponibles en distintos materiales y colores, e incluyen diferentes formas de pocillos y capacidades de volumen. Con tantas opciones, a veces resulta difícil elegir la óptima para un ensayo concreto. Aquí intentaré resumir las principales características, centrándome en las aplicaciones espectrofotométricas.
Aunque existen pequeñas diferencias de tamaño y posición de los pocillos entre los distintos tipos de microplacas de los diferentes fabricantes, todas las placas de microtitulación tienen las mismas dimensiones. Los pocillos suelen disponerse en una matriz rectangular y suelen presentarse en formatos de 6, 12, 24, 48, 96, 384 y 1536 pocillos (fig. 2). También existe una disposición de 3456 pocillos, pero no se utiliza con frecuencia.
 El volumen de llenado de cada pocillo depende de la disposición. El formato más utilizado es el de 96 pocillos (hasta 300 µL/pocillo). Las disposiciones de mayor densidad suelen emplearse con fines de miniaturización. Además de soportar más muestras, los formatos de 384 pocillos (hasta 100 µL/pocillo), 1536 pocillos (hasta 15 µL/pocillo) e incluso 3456 pocillos (hasta 5 µL/pocillo) reducen los volúmenes de reactivos y, en consecuencia, los costes (Tabla 1).
El volumen de llenado de cada pocillo depende de la disposición. El formato más utilizado es el de 96 pocillos (hasta 300 µL/pocillo). Las disposiciones de mayor densidad suelen emplearse con fines de miniaturización. Además de soportar más muestras, los formatos de 384 pocillos (hasta 100 µL/pocillo), 1536 pocillos (hasta 15 µL/pocillo) e incluso 3456 pocillos (hasta 5 µL/pocillo) reducen los volúmenes de reactivos y, en consecuencia, los costes (Tabla 1).
Como regla general, un tercio del volumen máximo de llenado es el volumen más bajo recomendado para que un pocillo tenga una medición eficiente y realista. Por lo tanto, no se debe bajar de 100 µL para una placas de microtitulación estándar de 96 pocillos.
Las microplacas de 96 pocillos de media área (hasta 170 µL/pocillo) son soluciones intermedias. Esencialmente, tienen el mismo tamaño de pocillo que la disposición de 384 pocillos, pero mantienen las dimensiones exteriores y las posiciones de los pocillos de una de 96 pocillos. En consecuencia, los pocillos son más pequeños y permiten reducir hasta un 50% el volumen de la muestra. Este formato suele utilizarse como alternativa al de 384 pocillos cuando se requieren volúmenes bajos pero no son necesarias la automatización y la alta capacidad de procesamiento.
Un concepto similar se aplica a los diseños de 384 pocillos en formato de bajo o pequeño volumen (a veces también llamados formato de "base alta" o formato de pocillo elevado). Estas placas tienen el mismo tamaño de pocillo que una disposición de 1536 pocillos con las dimensiones exteriores y las posiciones de los pocillos de una placa de 384 pocillos. Asimismo, los volúmenes de muestra pueden reducirse en más de un 50% en comparación con una placa estándar de 384 pocillos. Además del volumen, la forma de los pocillos también se ve afectada: mientras que las disposiciones normales de 384 pocillos tienen pocillos de forma cuadrada, las de bajo volumen los tienen redondos.
Tabla 1: Comparación de las capacidades de volumen de llenado de las distintas disposiciones.
| Número de pozo | Volumen recomendado |
| 6 | 2-5 mL |
| 12 | 2-4 mL |
| 24 | 0,5-3 mL |
| 48 | 0,5-1,5 mL |
| 96 | 100-300 µL |
| 96 media área | 50-170 µL |
| 384 | 30-100 µL |
| 384 bajo/pequeño volumen | 5-25 µL |
| 1536 | 5-25 µL |
| 3456 | 1-5 µL |
En general, los formatos de mayor densidad (es decir, 1536 y 3456 pocillos) no pueden pipetearse a mano y se necesita una máquina de pipeteo. El pipeteado manual sigue siendo posible en los pocillos 384, pero resulta tedioso y no suele recomendarse. En consecuencia, hay que sopesar si los mayores costes de manipulación asociados al trabajo con microplacas de 1536 o 3456 pocillos se ven contrarrestados por el ahorro de costes que supone la miniaturización. Este suele ser el caso de las instalaciones de cribado de alto rendimiento, pero no de la mayoría de los laboratorios de ciencias de la vida.
Las placas para ELISA suelen venir con 96 pocillos y constan de doce tiras separadas de ocho pocillos (fig. 3). Esta arquitectura simplifica el uso y la manipulación parciales.
Las placas de microtitulación pueden fabricarse con distintos materiales. Los más utilizados son los polímeros policarbonato, poliestireno y cicloolefina. La elección del polímero afecta a la transmisión de la luz, la autofluorescencia, la absorción de agua y el intercambio de gases y, en consecuencia, influye en el uso, las aplicaciones y la calidad de los ensayos.
Normalmente, el material más utilizado para los consumibles plásticos de laboratorio es el poliestireno. Su transparencia lo hace ideal para la detección óptica, los ensayos de absorbancia (como ELISA) y la microscopía con modificaciones moderadas. Sin embargo, el poliestireno no transmite la luz ultravioleta (< 320 nm) y, por tanto, es inadecuado para la cuantificación de ARN y ADN. Para este fin, el copolímero de ciclicolefina (COC) se presenta con una transmisión de luz ultravioleta mejorada en el rango de 200 - 400 nm y con baja autofluorescencia (fig. 4).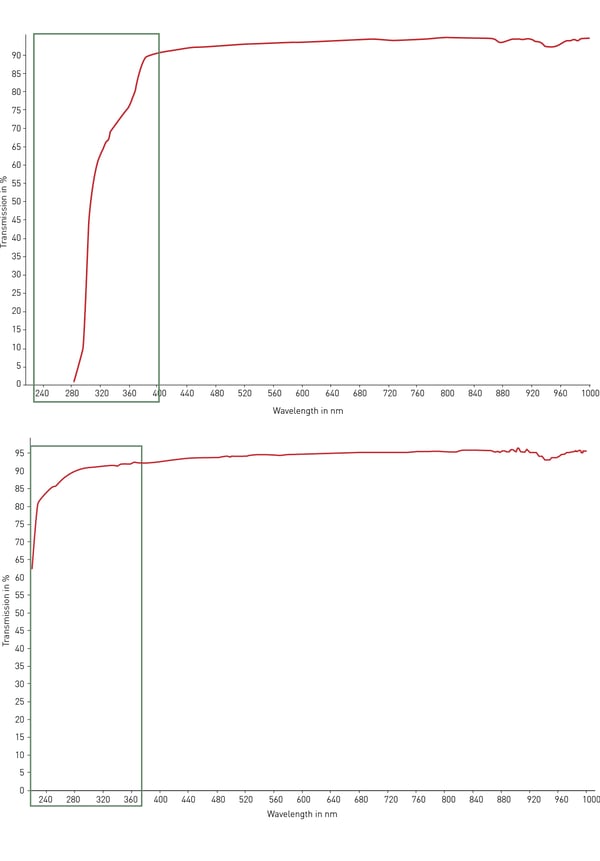 Para las aplicaciones ópticas y de microscopía, así como para el cribado de alto contenido, el vidrio y el cuarzo son los mejores materiales posibles en cuanto a transparencia, autofluorescencia y transmisión de la luz. Sin embargo, estos materiales son muy caros, frágiles y no suelen ser desechables.
Para las aplicaciones ópticas y de microscopía, así como para el cribado de alto contenido, el vidrio y el cuarzo son los mejores materiales posibles en cuanto a transparencia, autofluorescencia y transmisión de la luz. Sin embargo, estos materiales son muy caros, frágiles y no suelen ser desechables.
Además de las propiedades ópticas, la absorción de agua y el intercambio de gases desempeñan un papel importante en las aplicaciones celulares. Además, las propiedades mecánicas afectan a la manipulación, especialmente por sistemas automatizados. Las propiedades térmicas pueden desempeñar un papel importante en aplicaciones de alta temperatura (por ejemplo, placas PCR) o cuando se necesitan selladores.
El policarbonato y el polipropileno se utilizan principalmente para placas PCR (fig. 5) y para muestras sometidas a grandes cambios de temperatura (por ejemplo, almacenamiento a -80°C). Además de la estabilidad térmica, para el almacenamiento también se requiere resistencia a numerosos disolventes e inercia biológica.
Las microplacas suelen presentarse en cuatro colores: transparente, negro, blanco y gris (fig. 6). Dependiendo del modo de detección utilizado, el color puede afectar a la relación señal/fondo y a la diafonía entre pocillos cuando hay muestras muy brillantes y poco brillantes adyacentes. En consecuencia, una elección de color subóptima puede tener un impacto negativo en sus datos.
 Las microplacas transparentes (incluidas las transparentes a la luz UV) son necesarias para los ensayos de absorbancia, ya que la luz tiene que atravesar la muestra en este modo de detección.
Las microplacas transparentes (incluidas las transparentes a la luz UV) son necesarias para los ensayos de absorbancia, ya que la luz tiene que atravesar la muestra en este modo de detección.
Las microplacas negras (oscurecidas por la presencia de carbono) apagan parcialmente la señal de la muestra. Esto sucede porque el color negro absorbe parcialmente la señal luminosa procedente de la muestra. En consecuencia, estas placas son muy adecuadas para la intensidad de fluorescencia, incluyendo FRET, y para ensayos de polarización de fluorescencia. Por lo general, se trata de modos de detección con una señal de alta intensidad y el uso del color negro ayuda a reducir el fondo, la autofluorescencia y la diafonía entre pocillos, proporcionando una mejor relación señal/blanco.
Por lo general, las microplacas negras no se recomiendan para ensayos de luminiscencia, fluorescencia con resolución temporal (TRF ) y TR-FRET, ya que estos modos de detección suelen tener un rendimiento de señal comparativamente bajo que se vería aún más atenuado por el color negro. Para estos ensayos se recomiendan las placas blancas, que incluyen dióxido de titanio. El color blanco del pocillo refleja parcialmente la señal de la muestra, ayudando a maximizarla. El inconveniente es que las microplacas blancas también aumentan la señal del blanco. Sin embargo, ésta suele ser bastante baja en los ensayos luminiscentes. En TRF, la ventana de medición retardada elimina la influencia del fondo.
Una solución intermedia entre el blanco y el negro son las microplacas grises. Éstas se recomiendan específicamente para AlphaScreen® y AlphaLISA®, ya que reducen la diafonía y el fondo sin dejar de proporcionar buenas señales.
Si desea más información sobre la influencia del color de la microplaca en los resultados de las mediciones en diferentes modos de detección y desea ver datos que demuestren los efectos, visite HowTo Note 6: How to choose the best microplate colour for my assay (Nota práctica 6: Cómo elegir el mejor color de microplaca para mi ensayo).
Los pocillos pueden ser circulares o cuadrados, estos últimos con esquinas rectas o redondeadas. Los pocillos cuadrados contienen un mayor volumen de muestra y aumentan el área de transmisión de luz en comparación con los pocillos redondos. Los pocillos redondos tienen un área total más pequeña y son más adecuados para la agitación. Además, como los pocillos redondos normalmente no comparten una pared común con los pocillos adyacentes, se ven menos afectados que los cuadrados por la diafonía de señales a través de la pared de plástico del pocillo.
Los fondos de pocillos también tienen diferentes formas: Fondo en F, en V, en U y en C (fig. 7). Los pocillos con fondo F (plano) proporcionan la mejor transmisión de luz, son ideales para cultivos celulares adherentes y son adecuados para ensayos de lectura desde el fondo con lectores de placas o microscopios.
Los pocillos de fondo en V (cónicos) permiten la máxima recuperación de volumen de muestras pequeñas y valiosas debido a su forma. Sin embargo, la forma cónica es desventajosa para aplicaciones espectrofotométricas o de imagen. En consecuencia, los pocillos en forma de V se utilizan principalmente para el almacenamiento de muestras y el pipeteado preciso.
Un fondo de pocillo redondeado (fondo en U) facilita la mezcla, el lavado y el recubrimiento. Los pocillos con fondo en U permiten un pipeteado fácil y sin residuos y se utilizan normalmente para células en suspensión y esferoides.
Los pocillos de fondo curvo (fondo en C) son un compromiso entre los pocillos de fondo en F y los de fondo en U. El fondo plano los hace adecuados para mediciones ópticas, mientras que los bordes redondeados facilitan la mezcla y el lavado.

Las propiedades superficiales del pocillo desempeñan un papel importante. Aquí, la muestra y el material del pocillo interactúan entre sí. Por lo general, existen tres tipos principales de microplacas: de baja unión (low-binding), de unión media (medium-binding) y de alta unión (high-binding). La unión se ve afectada por las propiedades físicas del material y puede modificarse aplicando diferentes revestimientos.
Para aplicaciones de espectroscopia bioquímica y cribado de alto rendimiento, el poliestireno sin revestimiento suele ser el material elegido y se clasifica como de unión media.
Las placas de baja unión (low-binding) evitan la unión de ácidos nucleicos, proteínas y péptidos a la superficie del pocillo. En este caso, un recubrimiento específico reduce el fondo del ensayo y mejora la relación señal-ruido.
Las microplacas de alta unión (high-binding) suelen utilizarse para ensayos que requieren la inmovilización de moléculas en la superficie del pocillo. Uno de los usos más conocidos son los ensayos ELISA. Aquí, los recubrimientos y tratamientos específicos introducen un número definido de grupos hidrófilos para facilitar la adsorción pasiva de biomoléculas (por ejemplo, anticuerpos). Las placas de adhesión media y alta suelen diferir en el número de grupos polares disponibles.
Un ejemplo de cómo el recubrimiento de las placas puede afectar a los datos biológicos se demostró mediante un ensayo de actividad del proteasoma realizado con placas de baja unión, unión media y alta unión. En este estudio, los investigadores obtuvieron resultados diferentes y demostraron que el comportamiento del ensayo del proteasoma se veía afectado por las propiedades de las microplacas. La actividad del proteasoma se determinó con un sustrato fluorescente del proteasoma, la 7-amino-4-metilcumarina (AMC), una etiqueta muy utilizada para este fin. Como los espectros de excitación y emisión de la AMC unida y no unida son diferentes, esto permitió detectar fácilmente la AMC libre liberada por la escisión proteolítica con un lector de placas de fluorescencia. Sin embargo, las curvas estándar de AMC libre mostraron diferencias significativas entre los tres tipos de placas. Como era de esperar, la placa de alta unión (high-binding) dio la señal más baja. Por lo tanto, deberían evaluarse diferentes microplacas para determinar la mejor para el ensayo, así como el papel de cualquier posible efecto específico de la placa.4
Los distintos recubrimientos de las placas también pueden influir sustancialmente en la formación de meniscos en la superficie del líquido, lo que puede afectar sustancialmente a las mediciones basadas en la absorbancia debido a un cambio en la longitud del trayecto, tal como se explica en la nota HowTo Note: How to deal with path length and meniscus in microplates.
Las placas normales no pueden utilizarse para cultivos celulares y ensayos basados en células, ya que no suelen ser estériles. Además de la esterilidad, se requieren tratamientos hidrófilos específicos de la superficie para facilitar la adhesión de las células al fondo del pocillo. Estos tratamientos hidrófilos suelen denominarse "tratados para cultivo celular" o TC-treated. También existen recubrimientos basados en proteínas de la matriz extracelular como el colágeno, la fibronectina y la laminina, así como recubrimientos sintéticos como con poli-lisinas. Las células en suspensión, los organoides y los esferoides suelen necesitar una superficie que repela las células.
Dado que los ensayos celulares a veces se evalúan durante varias horas o días, la evaporación de los pocillos que contienen células puede influir en los resultados y, en última instancia, provocar una disminución de la viabilidad celular. Algunos fabricantes ofrecen placas que incluyen un foso exterior que puede llenarse con líquido. Esto ayuda a aislar los pocillos, evitando así la evaporación, especialmente de los pocillos de los bordes que presentan un riesgo de evaporación.
Cuando se realizan ensayos basados en células, se suele recomendar la detección desde el fondo del pocillo por varias razones. En las placas blancas o negras normales, la lectura desde el fondo del pocillo no es posible y deben utilizarse fondos transparentes. Las paredes de los pocillos pueden ser blancas o negras dependiendo del ensayo. El fondo transparente puede ser de distintos materiales, desde plástico (poliestireno o copolímero de ciclicolefina) hasta vidrio o cuarzo. Aunque la detección es significativamente mejor con el vidrio y aún más con el cuarzo en comparación con el plástico, éstos también son significativamente más caros. Además, las placas de vidrio y cuarzo no son desechables y hay que limpiarlas y esterilizarlas en autoclave después de cada uso. Por lo tanto, hay que decidir si el mejor rendimiento, que conlleva un mayor coste y mantenimiento, justifica el uso de una placa de este tipo en comparación con una microplaca desechable más barata y fácil de usar con fondo de plástico transparente.
Los lectores de microplacas detectan y cuantifican las señales luminosas producidas por muestras líquidas en ensayos basados en microplacas. Estos instrumentos de laboratorio se utilizan en las ciencias de la vida y en la industria farmacéutica para cuantificar reacciones químicas, biológicas o físicas. Además de las aplicaciones biológicas, celulares, bioquímicas, farmacéuticas y de descubrimiento de fármacos, los lectores de microplacas también se utilizan en la investigación medioambiental y en la industria alimentaria o cosmética.
Los lectores de microplacas se presentan como instrumentos monomodo o multimodo capaces de cuantificar muestras en diferentes modos, como absorbancia, intensidad de fluorescencia, luminiscencia o fluorescencia resuelta en el tiempo, TR-FRET, polarización de fluorescencia y AlphaScreen. Dependiendo de su método de selección de longitud de onda, los lectores de placas pueden ser monocromáticos o basados en filtros.
Su uso suele mejorar la eficiencia en las prácticas de laboratorio y ayuda a ahorrar costes de reactivos y a reducir el tiempo operativo. Para obtener una visión general de cómo se utilizan hoy en día los lectores de microplacas, consulte nuestra base de datos de notas de aplicación.
A pesar de las normas ANSI/SLAS, las placas de distintos fabricantes presentan ligeras variaciones en cuanto a dimensiones y posición de los pocillos. Esto puede influir en los datos medidos. Incluso un pequeño desfase en la profundidad o anchura de la posición de los pocillos en una línea con 24 o 48 pocillos (para una placa de 384 y 1536 pocillos, respectivamente) puede hacer que las mediciones ya no se realicen en el centro del pocillo, sino, en el peor de los casos, en la pared de plástico entre dos muestras.
En consecuencia, los lectores BMG LABTECH vienen con una base de datos de selección de microplacas que incluye más de 50 disposiciones de placas diferentes de distintos fabricantes.
Además de los lectores de microplacas, existen otros instrumentos diferentes que manipulan o gestionan microplacas. Estos instrumentos se utilizan específicamente en la automatización de laboratorios. Algunos ejemplos son los manipuladores de líquidos y lavadores utilizados para dispensar o retirar líquidos de y a diferentes placas, brazos robóticos y cintas transportadoras para transportar placas entre instrumentos, apiladores de placas para almacenarlas durante periodos cortos y hoteles de placas o incubadoras para almacenamiento a más largo plazo. Además, los selladores y deselladores de placas aplican y retiran láminas de sellado. En el siguiente vídeo puede verse un ejemplo de manipulación automatizada:

En conjunto, los lectores multimodo de BMG LABTECH combinan alto desempeño con ensayos miniaturizados, compatibilidad con opciones de manipulación automatizada, tiempos de medición cortos y permiten ahorrar materiales y otros recursos.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series