
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Aumente la sensibilidad de sus ensayos con la fluorescencia de resolución temporal, reduciendo el ruido de fondo para realizar inmunoensayos y estudios de interacción precisos.
La fluorescencia es la emisión de luz por una molécula al ser excitada por una luz de longitud de onda más corta que la emitida.
La detección de la fluorescencia puede dividirse principalmente en dos tipos de mediciones: fluorescencia en estado estacionario (steady-state) y fluorescencia de resolución temporal. La principal diferencia entre estos dos métodos se basa en la naturaleza y las propiedades de las moléculas fluorescentes (fluoróforos) utilizadas y el consiguiente tiempo de detección.
El estado estacionario es el modo de detección fluorescente más extendido y suele denominarse "intensidad de fluorescencia". Los fluoróforos estándar (por ejemplo, fluoresceína, rodamina, etc.) emiten luz a una longitud de onda específica en cuestión de nanosegundos tras la excitación. Este intervalo de tiempo tan corto entre la excitación y la emisión permite la detección casi concomitante de la señal de emisión fluorescente con la excitación de la muestra.
El segundo tipo, la fluorescencia de resolución temporal (TRF), se controla en función del tiempo tras la excitación. A diferencia de la intensidad de fluorescencia en estado estacionario, la fluorescencia de resolución temporal se basa en la detección de decaimientos de intensidad y/o en la detección retardada de la señal de emisión tras la excitación. En las mediciones de fluorescencia de resolución temporal, el pulso de luz de excitación es más corto que el tiempo de decaimiento de la señal fluorescente. La detección de fluorescencia de resolución temporal sólo puede lograrse cuando la señal de emisión del fluoróforo se prolonga hasta el rango de los micro o incluso milisegundos y no es de corta duración dentro de los nanosegundos como en el caso de las etiquetas comunes (fig.1).
Los lantánidos (Ln) son un grupo de elementos químicos metálicos excepcionalmente fluorescentes que a menudo se conocen colectivamente como "elementos de tierras raras". Los lantánidos tienen coeficientes de absorción (excitación) muy bajos y tasas de emisión lentas. Esto se traduce en tiempos de decaimiento de la fluorescencia prolongados, de entre 0,5 y 3 milisegundos (tiempos de vida largos). Todos los lantánidos forman cationes trivalentes (Ln3+) y emiten en solución acuosa. Además, sus picos de emisión son muy agudos y estrechos con un gran desplazamiento de Stokes[1].
Los lantánidos poseen propiedades favorables como sondas bioquímicas. Originalmente, se han empleado en sistemas biológicos como sondas luminiscentes para el calcio. De hecho, se ha demostrado que la luminiscencia de los lantánidos es un sensor sensible de los sitios de unión del Ca2+ en las proteínas[2].
Su prolongado decaimiento de fluorescencia los convierte en fluoróforos ideales para aplicaciones de fluorescencia de resolución temporal. Cuatro de ellos, el europio, el terbio, el samario y el disprosio, han encontrado un amplio uso en las ciencias de la vida, en particular en inmunoensayos de fluorescencia de resolución temporal, siendo el europio y el terbio los más utilizados (fig. 2).
Los iones de europio (Eu3+), en particular, se utilizan con frecuencia como etiquetas para la detección de fluorescencia de resolución temporal en ensayos inmunológicos. Además de la fluorescencia de larga emisión, el europio muestra un gran desplazamiento de Stokes (290 nm) sin solapamiento entre el espectro de excitación y el de emisión, y con sólo 10 nm de ancho de banda, un espectro de emisión muy nítido a 615 nm (fig. 3)[3] .
Como la emisión de los lantánidos suele ser demasiado débil para las aplicaciones de fluorescencia de resolución temporal, por lo general no se excitan directamente, sino que se incrustan en una especie de "jaula" que recoge la luz. Esta jaula, que suele ser un quelato o un criptato, permite tanto la captación como la transferencia de energía a los iones lantánidos, lo que se traduce en intensidades de emisión más elevadas (fig. 4). Cabe mencionar que el espectro de excitación del complejo jaula-lantánido refleja el espectro de absorción de la "jaula" y no del propio lantánido[4].
Además de una mayor señal de emisión, la quelación hace posible la conjugación del ion lantánido con componentes biológicos (por ejemplo, anticuerpos, receptores, ligandos, etc.), un requisito obligatorio para varias aplicaciones de fluorescencia de resolución temporal.
De forma similar a la detección de la intensidad de fluorescencia, la configuración para las mediciones de fluorescencia de resolución temporal consta de una fuente de luz, un dispositivo óptico para la selección de la longitud de onda y un detector de tubo fotomultiplicador (PMT).
Como el complejo lantánido-quelato-cripto se excita normalmente a 337 nm, se utiliza una lámpara de destellos de xenón o un láser específico como fuente de luz para la detección de fluorescencia de resolución temporal. Los lectores de placas multimodo están equipados con una lámpara de destellos de xenón de banda ancha, ya que ofrece más flexibilidad para múltiples métodos de detección. Los lectores de gama alta pueden ofrecer además un láser opcional de excitación de fluorescencia de resolución temporal. El láser concentra más energía en las longitudes de onda de excitación específicas de los lantánidos y posiblemente conduce a mejores resultados con una mejor discriminación entre señales bajas y altas. Sin embargo, dada la fuerte excitación en torno a 337 nm, se trata de una fuente de luz de un solo propósito que no puede utilizarse como fuente de excitación para otros métodos de detección que no sean la fluorescencia de resolución temporal.
En cuanto a la selección de la longitud de onda, tanto los lectores de placas basados en filtros como los basados en monocromadores pueden emplearse para la detección de ensayos de fluorescencia de resolución temporal. Como los lectores basados en filtros suelen ser más sensibles que los monocromadores debido a su mayor transmisión de luz, se recomiendan para ensayos de fluorescencia de resolución temporal con un rendimiento limitado de fotones. Normalmente, los ensayos de transferencia de energía de fluorescencia de resolución temporal son especialmente difíciles para los lectores basados en monocromadores.
Como detectores se utilizan tubos fotomultiplicadores (PMT). Debido a las propiedades de emisión prolongada de los lantánidos, en la fluorescencia de resolución temporal, el detector PMT se enciende después de que se haya producido la excitación. Esto permite que la señal autofluorescente de corta duración se desvanezca. La intensidad de la señal de emisión se integra entonces en función del tiempo para una ventana temporal específica. Estos dos parámetros se denominan "inicio de integración" y "tiempo de integración" y suelen estar en el rango de los microsegundos (fig. 5).
Los lectores de microplacas de gama alta también pueden estar equipados con los llamados PMT de recuento de fotones para fluorescencia de resolución temporal. Mientras que normalmente los lectores de microplacas se limitan a dar un valor de integración para el área bajo la curva durante el tiempo de integración, la fluorescencia de resolución temporal -dedicada a la detección por recuento de fotones- monitoriza toda la curva de decaimiento del lantánido.
En el lector PHERAstar FSX, la detección por recuento de fotones permite medir y visualizar la curva de desintegración de la emisión con una resolución temporal de 2 microsegundos. Esta función exclusiva denominada monitorización de la curva de decaimiento simplifica el desarrollo de ensayos de fluorescencia de resolución temporal, ayudando a optimizar los parámetros de temporización y mejorando así la detección de la señal y reduciendo el ruido de fondo.
Los inmunoensayos basados en fluorescencia de resolución temporal se utilizan para cuantificar moléculas específicas, como proteínas o citocinas. Se basan en el reconocimiento de la diana y la unión de anticuerpos específicos marcados con un fluoróforo. El análisis y la cuantificación de la señal fluorescente proporcionan indirectamente información sobre las moléculas diana. Los inmunoensayos son cuantitativos, muy sensibles y ofrecen la posibilidad de detección multiparamétrica (multiplexación).
Al igual que los ensayos ELISA clásicos, los inmunoensayos de fluorescencia de resolución temporal suelen utilizar un anticuerpo de captura unido al fondo del pocillo de la microplaca. A medida que las muestras se incuban en estos pocillos, el anticuerpo captura la molécula diana en la placa. Tras eliminar la muestra no unida lavando la placa, se añade un segundo anticuerpo unido covalentemente a un quelato de lantánido, normalmente europio. Éste se une a la molécula diana, mientras que el segundo anticuerpo no unido se elimina por lavado. La cantidad de anticuerpo marcado con lantánidos es proporcional a la concentración de la molécula diana en la muestra. Los inmunoensayos de fluorescencia fr resolución temporal pueden realizarse como ensayos directos o competitivos.
Para liberar las moléculas de europio de su "jaula" en el anticuerpo es necesario un paso de potenciación disociativa por tres razones: en primer lugar, los lantánidos tienen una escasa absorción de luz; en segundo lugar, rara vez se excitan directamente; y en tercer lugar, los quelatos de lantánidos sólo son poco fluorescentes cuando se conjugan con componentes biológicos (anticuerpos en este caso). La disociación se promueve mediante la adición de una solución específica comúnmente denominada "solución potenciadora". Además de disociar el lantánido, la solución promueve la formación de una nueva "jaula" de quelato que incorpora el cromóforo necesario para la excitación del lantánido. El quelante-cromóforo de la solución potenciadora se utiliza para absorber y transferir la luz de excitación al lantánido, aumentando significativamente la intensidad de la señal de emisión (fig. 6).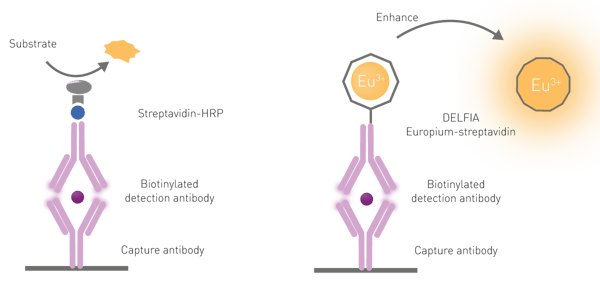
Las muestras se excitan mediante un pulso de luz a una longitud de onda específica, normalmente 337 nm. La detección se realiza en función del tiempo, en función del decaimiento de la señal de autofluorescencia. Esto significa que la detección de fluorescencia de resolución temporal sólo comienza tras el agotamiento de la señal de autofluorescencia de vida corta (microsegundos). La señal de emisión detectada se integra para una ventana de tiempo específica y los datos se miden como intensidad integrada, no como decaimiento temporal. Como la cantidad de analito es proporcional a la señal de emisión resuelta en el tiempo, puede cuantificarse fácilmente con el uso de una curva estándar.
Uno de los inmunoensayos de fluorescencia de resolución temporal más utilizados es DELFIA®.
DELFIA (Dissociation-Enhanced Lanthanide Fluorescent Immunoassay, inmunoensayo fluorescente de lantánidos con disociación mejorada) es un ensayo heterogéneo basado en el lavado de fluorescencia de resolución temporal desarrollado según un principio y un flujo de trabajo similares a los de ELISA. Se dice que supera las limitaciones típicas de los ensayos ELISA, proporcionando un rango dinámico más amplio y señales estables que pueden medirse hasta meses después de la ejecución del ensayo. Para la detección DELFIA, los lectores de placas deben estar equipados con detección de fluorescencia de resolución temporal con excitación a 337 nm y emisión a 615 nm.
En los ensayos DELFIA, los anticuerpos de captura se unen a la microplaca. Tras la adición de la muestra y una serie de pasos de lavado para eliminar la muestra no unida, se añade un anticuerpo de detección marcado con europio. Por último, se añade una solución potenciadora tras una serie final de lavados. Como se ha mencionado anteriormente, los ensayos DELFIA requieren un paso de realce disociativo para producir una señal fluorescente. Esta disociación promueve la formación de un nuevo quelato altamente fluorescente en una solución micelar estable. En la nota de aplicación "Time-Resolved Fluorescence (TRF) immunoassay in 384-well format using a matched antibody pair kit and the PHERAstar FSX" se muestra un ejemplo de inmunoensayo DELFIA.
Aunque son robustos y muy sensibles, los ensayos DELFIA no son adecuados para el cribado de alto rendimiento, ya que el procedimiento implica pasos de unión, incubación y lavado.
Los exosomas son vesículas extracelulares de origen endosomal que contienen ácidos nucleicos, proteínas y lípidos. Facilitan la comunicación intercelular entre diferentes tipos de células dentro de un organismo. Los kits de detección de exosomas TRIFic™de fluorescencia de resolución temporal detectan la presencia de exosomas basándose en la expresión de proteínas de membrana específicas.
Existen sondas fluorescentes específicas sensibles al oxígeno y al pH para el análisis de parámetros metabólicos celulares en modo de fluorescencia de resolución temporal. En notas de aplicación específicas, mostramos cómo el consumo de oxígeno intracelular y extracelular , así como la actividad glucolítica, pueden determinarse en tiempo real en células vivas.
Probablemente, la otra aplicación más popular de la fluorescencia de resolución temporal se puede encontrar en TR-FRET ( transferencia de energía de fluorescencia de resolución temporal). Su uso principal se encuentra en aplicaciones de cribado de fármacos y de alto rendimiento, ya que los ensayos de transferencia de energía de fluorescencia de resolución temporal son robustos y fáciles de automatizar y miniaturizar. Su principal aplicación son los estudios de interacción proteína-proteína o ligando-receptor.
Todas las muestras biológicas emiten autofluorescencia, que suele ser un factor limitante de la sensibilidad de los ensayos. Dado que decae en nanosegundos, las mediciones de fluorescencia de resolución temporal (time-gated) en el intervalo de micro o milisegundos permiten detectar la señal de emisión de los lantánidos una vez agotada la señal de autofluorescencia. El ruido fluorescente "de corta duración" (señales de fondo y luz de excitación dispersa) se elimina y las señales de fluorescencia de resolución temporal (de larga duración) pueden medirse con una sensibilidad muy alta, siendo la única señal de fondo la etiqueta unida de forma no específica. Esto reduce el ruido de fondo y aumenta la sensibilidad en comparación con la detección de la intensidad de fluorescencia en estado estacionario.
La diferencia entre los máximos de las longitudes de onda de excitación y emisión (picos) se define como desplazamiento de Stokes. Para muchos fluoróforos de estado estacionario disponibles en el mercado, éste es relativamente estrecho y da lugar a la autoextinción (self-quenching) de la señal debido al solapamiento entre los espectros de absorción y emisión. Por el contrario, los lantánidos tienen grandes desplazamientos de Stokes, lo que aumenta en gran medida la relación señal/fondo (S/B) en la detección de fluorescencia de resolución temporal.
Los lantánidos tienen un alto rendimiento cuántico con una mayor intensidad de fluorescencia que los fluoróforos "normales". Esto mejora significativamente la sensibilidad del ensayo en fluorescencia de resolución temporal. Cabe destacar que el alto rendimiento cuántico hace que los lantánidos sean perfectamente adecuados como donantes, pero no como aceptoras.
Si los inmunoensayos de fluorescencia de resolución temporal se detienen antes del paso de disociación/mejora y se almacenan adecuadamente, los ensayos son estables hasta 10 años, según los fabricantes. El único paso necesario para revivirlos es la adición de la solución de realce.
Como ya se ha comentado, los quelatos suelen incrustar lantánidos en "jaulas" que tienen la función de estabilizar, unir el fluoróforo a una molécula o potenciar sus propiedades fluorescentes. En la detección de fluorescencia con resolución temporal, este último paso es necesario para aumentar las intensidades de emisión que serían bastante pobres si los lantánidos estuvieran en su estado "natural". El cambio entre estos diferentes tipos de jaulas supone, sin embargo, una limitación significativa, ya que se requieren múltiples pasos intermedios como el lavado o la adición de soluciones. Este no suele ser el caso de los ensayos basados en la intensidad de fluorescencia.
Aunque es más sensible y eficiente, la detección por fluorescencia de resolución temporal requiere un mayor gasto en reactivos e instrumentación, en comparación con los métodos de intensidad de fluorescencia.
Los ensayos de fluorescencia de resolución temporal suelen requerir la detección desde la parte superior del pocillo y normalmente se realizan en placas blancas. Como la detección retardada elimina la autofluorescencia y reduce el fondo, las placas blancas son beneficiosas. Reflejan y realzan la emisión de luz, proporcionando señales más fuertes. Las placas negras se sugieren en caso de que una señal fuerte pueda saturar el detector.
Para ensayos celulares de fluorescencia de resolución temporal, se recomienda la detección desde el fondo de una placa con paredes blancas/negras y fondo transparente. Sin embargo, como no todos los fondos transparentes son transparentes a los rayos UV, el plástico puede absorber la luz a 340 nm y, por tanto, reducir significativamente la luz de excitación (normalmente a 337 nm). Antes de realizar su ensayo de fluorescencia de resolución temporal, es aconsejable comprobar las especificaciones de su microplaca y utilizar placas con un fondo transparente a los rayos UV. Para más detalles, lea la entrada de nuestro blog"La microplaca: utilidad en la práctica".
Como ya se ha comentado, la detección con resolución temporal elimina la autofluorescencia. Sin embargo, los pasos de lavado tras la incubación con reactivos marcados con lantánidos y antes de la adición de la solución potenciadora son bastante críticos y pueden afectar a la calidad del ensayo. Estos pasos deben ser muy eficaces para eliminar todos los reactivos marcados no unidos. De no ser así, el ensayo producirá una señal de fondo elevada causada por la presencia de iones lantánidos no unidos de forma inespecífica.
Para los ensayos DELFIA, deben preferirse los tampones basados en tris-HCl a los basados en fosfatos. Por un lado, las altas concentraciones de fosfato pueden disociar el europio de su quelato durante largos periodos de incubación. Por otro lado, la señal máxima suele ser menor con un tampón a base de fosfato que con uno a base de tris-HCl.
Un pH bajo puede liberar el ion lantánido de su quelato. Esto puede afectar negativamente a la integridad del colorante y aumentar la unión no específica y el fondo en la detección de fluorescencia de resolución temporal. Además, tenga cuidado con la presencia de EDTA en sus reactivos, ya que puede inactivar los quelatos de lantánidos.
Como los lantánidos carecen de emisión de luz polarizada, no pueden utilizarse para mediciones de anisotropía/polarización de fluorescencia[5].
DELFIA es una marca registrada de Perkin Elmer, Inc.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series