
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Utilice la polarización de fluorescencia para estudios de unión, ensayos de cribado y análisis de interacciones moleculares.
La polarización de fluorescencia (PF) es un método de detección basado en la fluorescencia que se utiliza ampliamente para monitorizar interacciones moleculares en solución. A diferencia de la intensidad de fluorescencia, que se centra en la cuantificación de la intensidad de emisión a una longitud de onda específica y no tiene en cuenta su polarización, la polarización de fluorescencia analiza específicamente la intensidad de emisión resultante en diferentes planos de polarización.
La polarización de fluorescencia se utiliza normalmente para evaluar interacciones biomoleculares como la unión proteína-proteína y proteína-ADN, así como la actividad enzimática. Se ha adoptado tanto en la investigación básica como en el cribado de alto rendimiento.
Inicialmente, la polarización de fluorescencia se había utilizado principalmente en el campo del diagnóstico. En la década de 1960 se describió por primera vez un inmunoensayo de PF. En la investigación en ciencias de la vida, inicialmente las aplicaciones fueron al principio limitadas debido a la falta de instrumentos sensibles. En la actualidad, la PF está experimentando una gran popularidad en la investigación biológica. Esto se debe principalmente al mayor rendimiento y sensibilidad de los modernos lectores de microplacas, que pueden ofrecer resultados sólidos con una variabilidad mínima y ventanas de ensayo más amplias.
La luz es una onda electromagnética cuyo campo eléctrico oscila perpendicularmente a la dirección de propagación. La luz no polarizada se define como luz en la que la dirección de la oscilación de su campo eléctrico fluctúa aleatoriamente en el tiempo. Las fuentes de luz comunes, como la luz solar y las bombillas incandescentes y halógenas clásicas, producen luz no polarizada.
Si la dirección del campo eléctrico se restringe a un plano mediante un filtro específico, todas las ondas luminosas seleccionadas oscilarán en una única dirección, produciendo luz plana o polarizada. La fuente más común de luz polarizada son los láseres. La luz no polarizada puede considerarse como un conjunto de ondas luminosas polarizadas en diferentes planos sin un estado de polarización predominante (fig.1).
Según la orientación de su campo eléctrico, la luz polarizada se clasifica en lineal, circular y elíptica. La polarización lineal, cuyo campo eléctrico se limita a un único plano a lo largo de la dirección de propagación, es la más utilizada en las aplicaciones de las ciencias de la vida y en la que se centra este artículo. Para la reflexión y transmisión de la luz, los dos estados de polarización lineal más relevantes son el paralelo y el perpendicular (relativo al plano de incidencia).
La detección de la polarización de fluorescencia se basa en la teoría general de la detección de fluorescencia en estado estacionario que puedes encontrar en la página de intensidad de fluorescencia. Además, su detección se basa en el hecho de que el grado de polarización de un fluoróforo está inversamente relacionado con su velocidad de giro y en la observación de que la luz emitida por un fluoróforo puede tener diferentes intensidades en diferentes planos de polarización, típicamente perpendicular y paralelo al plano de excitación.
Cuando la luz polarizada en el plano excita una molécula fluorescente pequeña (normalmente <1,5 kDa) y no unida (el trazador), ésta emite principalmente luz no polarizada. Esto se debe al hecho de que una molécula pequeña y libre gira rápidamente en solución durante el tiempo que transcurre entre la excitación y la emisión y, en consecuencia, emite luz en diferentes planos de polarización (no polarizada).
Por el contrario, si la molécula fluorescente pequeña está unida a otra más grande (normalmente >10 kDa), su mayor volumen molecular ralentiza su rotación y da lugar a la emisión de luz predominantemente polarizada en el mismo plano que la fuente de excitación (fig. 2).
La polarización de la fluorescencia es, por tanto, la medida de la cantidad de rotación molecular que tiene lugar en el tiempo transcurrido entre la excitación y la emisión del trazador. Se calcula mediante la siguiente ecuación
P = (F|| - F⊥)/(F|| + F⊥)
Cuantitativamente, se define como la diferencia entre la intensidad de fluorescencia de emisión paralela (F||) y perpendicular (F⊥) al plano de luz de excitación, dividida por la intensidad total de fluorescencia de emisión.1
El valor P es un número sin dimensión, ya que se trata de una relación de intensidades luminosas. A menudo se expresa en milipolarización (mP), donde 1 P = 1000 mP. Aunque P tiene valores que oscilan entre -330 y 500 mP, rara vez se alcanzan los límites teóricos. En aplicaciones bioanalíticas, los datos típicos oscilan entre 10 y 300 mP (por ejemplo, fig. 3).
El término anisotropía se introdujo en 1960 y se utiliza frecuentemente en el contexto de la emisión polarizada. La anisotropía (designada como A o r) es la relación de las intensidades de emisión en la ecuación siguiente:
r = (F|| - F⊥)/(F|| + 2 F⊥)
F|| indica la intensidad tras la excitación polarizada verticalmente y la polarización vertical en la luz de emisión. F⊥ indica la intensidad cuando se utiliza un polarizador vertical en la excitación y un polarizador horizontal en la emisión. 2
La polarización de fluorescencia y la anisotropía están matemáticamente relacionadas y se utilizan indistintamente. Ambas se derivan de las intensidades de emisión de luz polarizada y no polarizada y representan un promedio de los estados unido/no unido de una molécula fluorescente. Para la mayoría de las aplicaciones, el contenido informativo de sus funciones es idéntico, ya que la anisotropía no aporta ninguna información adicional.3
Normalmente, la elección de un término u otro depende de consideraciones prácticas y de la costumbre. La polarización de la fluorescencia se utiliza con mayor frecuencia para describir toda la tecnología y en química clínica, mientras que la anisotropía es más común en biofísica y bioquímica.
La polarización de fluorescencia puede detectarse en un lector de microplacas y se basa en el mismo procedimiento y configuración que la intensidad de fluorescencia. Sin embargo, existen algunas diferencias relacionadas principalmente con la selección de los planos de polarización.
La muestra se excita a una longitud de onda específica mediante luz polarizada vertical (paralela). La fuente de luz de excitación suele ser una lámpara de xenón o halógena. Su luz blanca se filtra espectralmente mediante un filtro o un monocromador. El plano de polarización se selecciona mediante un filtro específico denominado polarizador.
El vector del campo eléctrico de la luz natural puede adoptar cualquier dirección de oscilación relativa a la dirección de propagación. Los polarizadores son elementos ópticos, normalmente películas finas, que pueden aislar una dirección del vector eléctrico. El polarizador de excitación se coloca entre la fuente de excitación y la muestra. La orientación relativa del plano vertical transmite luz paralela a la muestra y bloquea la luz polarizada perpendicular.
La luz emitida por una muestra se filtra espectralmente mediante un filtro o un monocromador para eliminar las longitudes de onda no deseadas. Además, la luz emitida debe separarse en ondas paralelas o perpendiculares en función de su orientación con respecto al plano de la luz de excitación polarizada. Esto es posible gracias a los polarizadores de emisión situados en la trayectoria de la luz entre la muestra y el detector, que suelen ser del mismo tipo que el polarizador de excitación. Por último, la intensidad de ambos planos polarizados se cuantifica mediante un detector, normalmente un tubo fotomultiplicador (PMT).
Los dos planos se detectan por separado. El enfoque más sencillo consiste en detectar los planos paralelo y perpendicular con dos mediciones secuenciales. Una vez detectada la intensidad de polarización paralela en la primera medición, se utiliza el polarizador de emisión girado 90° para detectar el plano horizontal (perpendicular) (fig. 4).
Los lectores de placas de polarización de fluorescencia de alta gama, como el PHERAstarFSX, puedenadquirir los dos planos de polarización simultáneamente, gracias a la tecnología de detección de doble emisión simultánea. Este enfoque ahorra tiempo y reduce la variabilidad generada por dos mediciones secuenciales.
Por lo general, los monocromadores no se recomiendan para la detección de PF debido a su baja transmisión intrínseca de la luz y a su elevado fondo (luz parásita). Estos factores concurren en el aumento de la variabilidad de la muestra, afectando negativamente a la ventana y robustez del ensayo.
Para la detección en el rango UV, los lectores deben estar equipados con una lámpara de xenón. No se recomiendan las lámparas halógenas debido a su escasa emisión por debajo de 400 nm. Además, se necesitan polarizadores UV específicos, ya que los normales tienen una transmisión deficiente en las longitudes de onda UV.
Los niveles bajos de polarización (P) indican que las moléculas fluorescentes no se han unido y se mueven libremente en la solución. Los niveles altos de P indican la presencia de un complejo molecular mayor. Aunque el rango de medición en aplicaciones bioanalíticas de 10 a 300 mP puede parecer bastante restringido, se pueden conseguir mediciones muy precisas con desviaciones estándar de ± 0,5 mP con lectores de microplacas multimodo de gama alta como el PHERAstar FSX o el CLARIOstarPlus.
La elección de un colorante fluorescente en ensayos PF es de importancia clave. Sus espectros de excitación y emisión deben diferir de las longitudes de onda de otras moléculas presentes en la solución para reducir la autofluorescencia y deben tener un gran desplazamiento de Stokes para reducir la influencia negativa de la dispersión de la luz. Los fluoróforos deben conjugarse fácilmente con el trazador, pero sin perturbar su giro ni interferir en la interacción. Además, deben tener un alto rendimiento cuántico (es decir, alta intensidad) y ser químicamente estables y fotoestables.4
Los fluoróforos más utilizados son el isotiocianato de fluoresceína (FITC) y los colorantes con espectros similares. Sin embargo, recientemente, impulsados por la mejora del rendimiento de los lectores de microplacas modernos, han ganado popularidad los colorantes rojos como Cy3B y Cy5. Dado que su bajo rendimiento fotónico intrínseco ya no representa una limitación debido a las mejoras técnicas en la detección de señales, su uso puede ser ventajoso para reducir los falsos negativos derivados de la autofluorescencia que suelen emitir en el rango verde y azul, y los falsos positivos causados por fenómenos de dispersión de la luz.5
Entre los enfoques utilizados para estudiar las uniones moleculares, la PF es única. Dado que se basa en una única estrategia de etiqueta fluorescente, no se requieren pasos de separación adicionales. En consecuencia, se pueden utilizar menos reactivos, y normalmente menos caros, en comparación con los métodos convencionales. Además, como la integridad de la muestra no se ve afectada, las muestras a menudo pueden medirse repetidamente, siempre que el pH, la temperatura y la viscosidad sean constantes.
La PF permite la monitorización directa de la relación libre/ligado de un trazador en solución en tiempo real, permitiendo el análisis de equilibrio con concentraciones muy bajas (normalmente hasta el rango picomolar). Sin embargo, debido a su naturaleza en tiempo real, los experimentos no se limitan al equilibrio, y la cinética de asociación/disociación puede analizarse fácilmente.
La PF es una técnica homogénea con un protocolo sencillo de mezcla y lectura que no requiere la separación de las especies unidas y libres que se van a medir. Los ensayos homogéneos proporcionan una cuantificación más precisa de los fenómenos de unión, ya que la reacción de unión no se ve alterada por pasos adicionales. Sin embargo, es importante señalar que otros ensayos homogéneos, como FRET, TR-FRET o AlphaScreen® requieren reacciones de marcaje adicionales además del marcaje único del trazador.
Además, la naturaleza ratiométrica de la PF elimina la influencia negativa que la absorbancia o la extinción del compuesto pueden tener en la adquisición de datos y permite la miniaturización. Todas estas razones han llevado a la adopción de los ensayos de PF en el cribado de alto rendimiento.
A pesar de todas sus ventajas, este sistema de medida tiene algunas limitaciones. La PF requiere grandes cambios en el volumen molecular para la generación de la máxima señal y ventana de ensayo. En el mejor de los casos, un ensayo de unión por polarización de fluorescencia puede monitorizar la interacción entre una molécula pequeña y una grande, y requiere el marcaje de la pareja de interacción más pequeña con un fluoróforo. En consecuencia, los trazadores suelen ser proteínas o péptidos pequeños, citocinas y compuestos químicos. Esto suele garantizar la mayor diferencia posible en el volumen molecular en el momento de la unión y, por tanto, la mayor ventana de ensayo posible. El ensayo de unión PF no es adecuado para la observación de la interacción de dos proteínas grandes.
Además, la autofluorescencia del compuesto y la dispersión de la luz pueden causar artefactos. Por lo tanto, normalmente se recomienda cuantificar el fondo de fluorescencia de un pocillo antes de añadir el colorante fluorescente y restarlo del cálculo. Como la autofluorescencia suele ser menos pronunciada a longitudes de onda más altas, puede utilizarse la adopción de colorantes rojos como BODIPY TMR o colorantes Cy5 para minimizar el ruido de fondo.6, 7
El ensayo de unión con PF puede emplearse para analizar fenómenos de interacción o disociación molecular en interacciones proteína-ligando o péptido-proteína, interacciones proteína-ADN, así como agregación de proteínas prefibrilares. Además, también puede utilizarse para identificar compuestos interferentes e inhibidores no específicos.
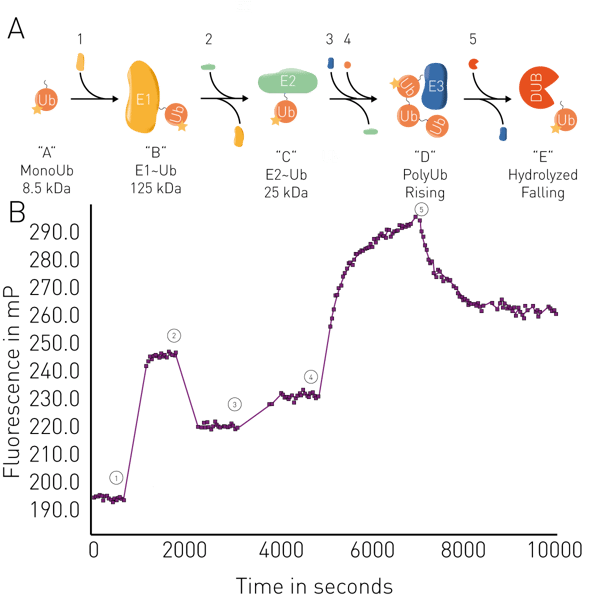
Otras aplicaciones incluyen el análisis de la fluidez de membrana en liposomas y membranas mitocondriales, y ensayos enzimáticos como proteólisis, síntesis de ARN, cinética de unión y conjugación/desconjugación de ubiquitina en tiempo real(fig. 5). Las aplicaciones en tiempo real para la ubiquitina pueden utilizarse, por ejemplo, en la degradación dirigida de proteínas para PROteolysis TArgeting Chimeras (PROTACs) o pegamentos moleculares, incluyendo estudios de su actividad de unión a sus dianas y la cinética de las interacciones. Los ensayos de unión de PF también pueden utilizarse para estudiar la degradación selectiva de proteínas derivada de interacciones específicas entre degrones y ligasas conocidos.
 Ensayos de polarización de fluorescencia en el cribado de moléculas pequeñas
Ensayos de polarización de fluorescencia en el cribado de moléculas pequeñas
En los años 90, la PF se adoptó en el entorno del cribado de fármacos para facilitar el proceso de descubrimiento de fármacos. Hoy en día, se utiliza de forma rutinaria en las instalaciones de cribado, debido a su formato homogéneo, rápido y cuantitativo. Dado que la PF suele ser linealmente proporcional al porcentaje de trazador unido/libre, se emplea con frecuencia para determinar los valoresIC50 de los fármacos candidatos.
En el descubrimiento de fármacos, se ha utilizado para estudiar diferentes dianas como GPCR, quinasas, fosfatasas y proteasas. Mientras que, en los estudios de interacción, la PF suele detectar un aumento del volumen molecular, en los ensayos de disociación y degradación enzimática se suele utilizar la disminución del volumen molecular como lectura.
Las principales aplicaciones de los ensayos de polarización de fluorescencia en HTS son el análisis de interacciones moleculares directas, así como de reacciones enzimáticas. Aquí, los lectores de microplacas rápidos y sensibles permiten el cribado eficaz de moléculas pequeñas para una gama cada vez mayor de clases de dianas. Algunos ejemplos son el cribado de inhibidores del regulador de la ubiquitinación y diana anticancerosa CSN5, así como el cribado de inhibidores de la H-prostaglandina D sintasa.
Polarización de fluorescencia HomoFRET
La transferencia de energía de resonancia de Förster (FRET) es un método común para estudiar eventos de interacción. Normalmente, los dos posibles socios de interacción se marcan con dos fluoróforos diferentes (donante y aceptor). Sin embargo, la FRET también puede tener lugar entre fluoróforos similares (homoFRET). La PF puede aplicarse a la homoFRET, ya que la transferencia de energía provoca una aleatorización en la polarización de la emisión, produciendo una señal despolarizada. La homoFRET-FP puede utilizarse para estudiar la acumulación de proteínas o los fenómenos de dimerización en una célula, como se describe en la nota de aplicación "Monitorización del empaquetamiento de gránulos de insulina en células vivas mediante detección por homoFRET-FP" (fig. 6).
El inmunoensayo de polarización de fluorescencia (FPIA) ha sido el primero en aplicarse en bioquímica. Se trata de un ensayo bioquímico competitivo utilizado para detectar antígenos o anticuerpos. En un inmunoensayo de polarización de fluorescencia, se utiliza como trazador un antígeno unido a un fluoróforo. Éste y un segundo antígeno suelen competir para unirse a un anticuerpo seleccionado. Una unión elevada entre el trazador y el anticuerpo suele dar lugar a una señal polarizada, mientras que si el antígeno no marcado está unido predominantemente por el anticuerpo, el trazador libre generará luz no polarizada. Este cambio es proporcional a la cantidad de antígeno presente en la muestra.8
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows