
PHERAstar FSX
Powerful and most sensitive HTS plate reader


시간 분해 형광으로 분석 감도를 높이고 배경 잡음을 줄여 정확한 면역 분석 및 상호작용 연구를 수행할 수 있습니다.
형광은 분자가 방출되는 파장보다 짧은 파장의 빛에 의해 여기된 후 빛을 발산하는 현상입니다.
형광 감지는 크게 정상 상태 형광과 시간 분해 형광의 두 가지 측정 유형으로 나눌 수 있습니다. 이 두 방법의 주요 차이점은 사용되는 형광 분자(형광 발광체)의 특성과 특성 및 그에 따른 검출 시간에 따라 달라집니다.
정상 상태는 가장 널리 사용되는 형광 감지 모드이며 일반적으로 "형광 강도"라고 합니다. 표준 형광체(예: 플루오레세인, 로다민 등)는 여기 시 나노초 이내에 특정 파장의 빛을 방출합니다. 여기와 방출 사이의 시간 간격이 매우 짧기 때문에 시료의 여기와 형광 방출 신호를 거의 동시에 감지할 수 있습니다.
두 번째 유형인 시간 분해 형광(TRF)은 여기 시 시간의 함수로 모니터링됩니다. 정상 상태 형광 강도와 달리, 시간 분해 형광은 여기 시 강도 감쇠 및 방출 신호의 지연 감지를 기반으로 합니다. 시간 분해 형광 측정에서 여기 광 펄스는 형광 신호의 감쇠 시간보다 짧습니다. 시간 분해 형광 검출은 형광체의 방출 신호가 일반적인 라벨처럼 나노초 이내의 짧은 수명이 아니라 마이크로초 또는 밀리초 범위로 연장되어야만 가능합니다(그림 1).
란타나이드(Ln)는 흔히 '희토류 원소'로 통칭되는 독특한 형광 금속 화학 원소 그룹입니다. 란타나이드는 흡수(여기) 계수가 매우 낮고 방출 속도가 느립니다. 그 결과 형광 감쇠 시간이 0.5~3밀리초(긴 수명)로 길어집니다. 모든 란타나이드 원소는 3가 양이온(Ln3+)을 형성하고 수용액에서 방출을 나타냅니다. 또한 방출 피크가 매우 날카롭고 좁으며 스토크스 이동이 큽니다[1].
란탄화물은 생화학 프로브로서 유리한 특성을 가지고 있습니다. 원래는 생물학적 시스템에서 칼슘에 대한 발광 프로브로 사용되어 왔습니다. 실제로 란타나이드 발광은 단백질의 Ca2+ 결합 부위에 대한 민감한 센서임이 입증되었습니다[2].
형광 감쇠가 오래 지속되기 때문에 시간 분해 형광 애플리케이션에 이상적인 형광 물질입니다. 이 중 유로퓸, 테르븀, 사마륨, 디스프로슘은 생명 과학, 특히 시간 분해 형광 면역 분석에서 널리 사용되고 있으며, 유로퓸과 테르븀이 가장 일반적으로 사용되고 있습니다(그림 2).
특히 유로늄 이온(Eu3+)은면역학적 분석에서 시간 분해 형광 검출을 위한 표지로 자주 사용됩니다. 유로늄은 형광을 길게 방출하는 것 외에도 여기 스펙트럼과 방출 스펙트럼이 겹치지 않는 큰 스토크스 시프트(290nm)와 10nm 대역폭으로 615nm에서 매우 선명한 방출 스펙트럼을 나타냅니다(그림 3)[3] .
란타나이드의 방출은 일반적으로 시간 분해 형광 애플리케이션에 사용하기에는 너무 약하기 때문에 일반적으로 직접 여기되지 않고 일종의 빛을 모으는 "케이지"에 내장됩니다. 이 케이지(가장 일반적으로 킬레이트 또는 크립트레이트)는 에너지 수집과 란타나이드 이온으로의 에너지 전달을 모두 허용하여 방출 강도를 높입니다(그림 4). 케이지-란타나이드 복합체의 여기 스펙트럼은 란타나이드 자체가 아닌 "케이지"의 흡수 스펙트럼을 반영한다는 점을 언급할 필요가 있습니다.[4][5]
킬레이트화는 더 높은 방출 신호 외에도 란타나이드 이온을 생물학적 성분(예: 항체, 수용체, 리간드 등)에 접합할 수 있게 해주며, 이는 여러 시간 분해 형광 애플리케이션의 필수 요건입니다.
형광 강도 검출과 마찬가지로 시간 분해 형광 측정을 위한 설정은 광원, 파장 선택을 위한 광학 장치, 광증배관(PMT) 검출기로 구성됩니다.
란타나이드-켈레이트/크립테이트 복합체는 일반적으로 337nm에서 여기되므로 시간 분해 형광 검출을 위한 광원으로 제논 플래시 램프 또는 특정 레이저가 사용됩니다.다중 모드 플레이트 리더기에는 광대역 제논 플래시 램프가 장착되어 있어 여러 검출 방법에 대한 유연성이 더 높습니다. 고급형 리더기는 옵션으로 전용 시간 분해 형광 여기 레이저를 추가로 제공할 수 있습니다. 이 레이저는 란타나이드의 특정 여기 파장에 더 많은 에너지를 집중시켜 낮은 신호와 높은 신호를 더 잘 구분하여 더 나은 결과를 도출할 수 있습니다. 그러나 약 337nm의 날카로운 여기 파장을 고려할 때, 이는 시간 분해 형광을 제외한 다른 검출 방법의 여기 소스로 사용할 수 없는 단일 목적 광원일 뿐입니다.
파장 선택과 관련하여, 시간 분해 형광 분석의 검출에는 필터 기반 및 모노크로메이터 기반 플레이트 리더기를 모두 사용할 수 있습니다. 필터 기반 판독기는 일반적으로 광 투과율이 높기 때문에 모노크로메이터보다 더 민감하므로 광자 수율이 제한된 TRF 분석에 권장됩니다. 일반적으로 시간 분해 형광 에너지 전달 분석은 모노크로메이터 기반 리더기에서는 특히 까다롭습니다.
광증배관(PMT)이 감지기로 사용됩니다. 란타나이드의 장시간 방출 특성으로 인해 시간 분해 형광에서는 여기가 발생한 후 PMT 감지기가 켜집니다. 이렇게 하면 수명이 짧은 자동 형광 신호가 페이드아웃됩니다. 그런 다음 방출 신호의 강도가 특정 시간 창에 대한 시간 함수로 통합됩니다. 이 두 파라미터를 "통합 시작"과 "통합 시간"이라고 하며 일반적으로 마이크로초 범위입니다(그림 5).
고급 마이크로플레이트 리더기에는 시간 분해 형광을 위한 소위 광자 카운팅 PMT를 장착할 수도 있습니다. 일반적으로 마이크로 플레이트 리더기는 단순히 적분 시간 동안 곡선 아래 영역에 대한 적분 값을 제공하지만, 시간 분해 형광 전용 광자 카운팅 검출은 란타나이드의 전체 감쇠 곡선을 모니터링합니다.
PHERAstar FSX 리더기에서 광자 계수 감지를 사용하면 2마이크로초의 시간 분해능으로 방출 감쇠 곡선을 측정하고 표시할 수 있습니다. 감쇠 곡선 모니터링이라는 이 고유한 기능은 시간 분해능 형광 분석 개발을 간소화하여 타이밍 파라미터를 최적화함으로써 신호 검출을 개선하고 배경 잡음을 줄입니다.
시간 분해 형광을 기반으로 하는 면역 분석은 단백질이나 사이토카인과 같은 특정 분자를 정량화하는 데 사용됩니다. 형광 표지된 특정 항체에 의한 표적 인식 및 결합에 의존합니다. 형광 신호의 분석과 정량화는 표적 분자에 대한 정보를 간접적으로 제공합니다. 면역 분석은 정량적이고 민감도가 높으며 다중 파라미터 검출(멀티플렉싱)의 가능성을 제공합니다.
기존의ELISA 분석과 마찬가지로, 시간 분해 형광 면역 분석은 일반적으로 마이크로 플레이트 웰의 바닥에 결합된 포획 항체를 사용합니다. 샘플이 이 웰에서 배양되면 항체가 플레이트의 표적 분자를 포획합니다. 플레이트를 세척하여 결합되지 않은 샘플을 제거한 후 란타나이드 킬레이트(가장 일반적으로 유로피움)에 공유 결합된 두 번째 항체를 추가합니다. 이렇게 하면 결합되지 않은 두 번째 항체가 씻겨 내려가는 동안 표적 분자와 결합합니다. 란타나이드 표지 항체의 양은 시료 내 표적 분자의 농도에 비례합니다. 시간 분해 형광 면역 분석은 직접 또는 경쟁 분석으로 수행할 수 있습니다.
첫째, 란타나이드는 빛 흡수율이 낮고, 둘째, 직접 여기되는 경우가 거의 없으며, 셋째, 란타나이드 킬레이트는 생물학적 성분(이 경우 항체)과 결합할 때만 형광이 약하기 때문에 항체의 '케이지'에서 유로퓸 분자를 해방시키기 위해서는 해리 강화 단계가 필요합니다. 해리는 일반적으로 "강화 용액"이라고 하는 특정 용액의 첨가에 의해 촉진됩니다. 이 용액은 란타나이드를 해리하는 것 외에도 란타나이드를 여기시키는 데 필요한 발색단을 포함하는 새로운 킬레이트 "케이지"의 형성을 촉진합니다. 인핸서 용액의 킬레이트 발색단은 여기 광을 흡수하여 란타나이드로 전달하여 방출 신호의 강도를 크게 증가시키는 데 사용됩니다(그림 6).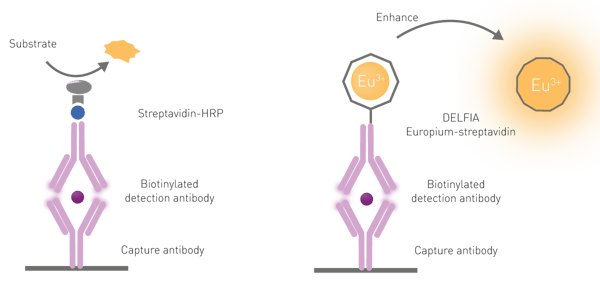
샘플은 특정 파장(일반적으로 337nm)의 빛 펄스에 의해 여기됩니다. 감지는 자동 형광 신호의 감쇠에 따라 시간 게이트로 이루어집니다. 즉, 시간 분해 형광 감지는 수명이 짧은 자가 형광 신호가 소진된 후(마이크로초)에만 시작됩니다. 감지된 방출 신호는 특정 시간 창에 대해 통합되며 데이터는 시간 감쇠가 아닌 통합 강도로 측정됩니다. 분석 물질의 양은 시간 분해 방출 신호에 비례하므로 표준 곡선을 사용하여 쉽게 정량화할 수 있습니다.
가장 일반적으로 사용되는 시간 분해 형광 면역 분석법 중 하나는DELFIA®입니다.
DELFIA(해리 강화 란타나이드 형광 면역 분석법)는 ELISA와 유사한 원리 및 워크플로우로 개발된 이종 시간 분해 형광 세척 기반 분석법입니다. ELISA 분석의 일반적인 한계를 극복하여 더 넓은 동적 범위와 분석 실행 후 수개월까지 측정할 수 있는 안정적인 신호를 제공하는 것으로 알려져 있습니다. DELFIA 검출을 위해서는 플레이트 리더기에 337nm에서 여기하고 615nm에서 방출하는 시간 분해 형광 검출 기능이 장착되어 있어야 합니다.
DELFIA 분석에서는 포획 항체가 마이크로 플레이트에 결합됩니다. 샘플을 추가하고 결합되지 않은 샘플을 제거하기 위한 일련의 세척 단계를 거치면 유로피움 표지 검출 항체가 추가됩니다. 마지막으로 일련의 마지막 세척 후에 강화 용액을 추가합니다. 위에서 언급했듯이 DELFIA 분석은 형광 신호를 생성하기 위해 해리성 강화 단계가 필요합니다. 이 해리는 안정적인 미셀 용액에서 새로운 고형광 킬레이트의 형성을 촉진합니다. DELFIA 면역 분석의 예는 애플리케이션 노트 "일치하는 항체 쌍 키트와 PHERAstar FSX를 사용한 384웰 형식의 시간분해형광(TRF) 면역 분석"에 나와 있습니다.
강력하고 매우 민감하지만, DELFIA 분석은 절차에 결합, 배양 및 세척 단계가 포함되므로 고처리량 스크리닝에는 적합하지 않습니다.
엑소좀은 핵산, 단백질, 지질을 포함하는 엔도솜 기원의 세포 외 소포체입니다. 엑소좀은 유기체 내에서 서로 다른 세포 유형 간의 세포 간 통신을 촉진합니다. TRIFic™시간 분해형 형광 엑소좀 검출 키트는 특정 막 단백질의 발현을 기반으로 엑소좀의 존재를 감지합니다.
특정 형광 산소 및 pH 민감성 프로브를 사용하여 시간 분해 형광 모드에서 세포 대사 파라미터를 분석할 수 있습니다. 특정 애플리케이션 노트에서는 살아있는 세포에서 세포 내 및 세포 외 산소 소비량과 해당 작용 활성을 실시간으로 측정하는 방법을 보여줍니다.
아마도 시간 분해 형광의 또 다른 가장 인기 있는 응용 분야는TR-FRET ( 시간 분해 형광 에너지 전달)에서 찾을 수 있을 것입니다. 시간 분해 형광 에너지 전달 분석은 강력하고 자동화 및 소형화가 용이하기 때문에 약물 및 고처리량 스크리닝 애플리케이션에서 주로 사용됩니다. 주요 응용 분야는 단백질-단백질 또는 리간드-수용체 상호 작용 연구입니다.
자가 형광은 모든 생물학적 시료에서 방출되며 일반적으로 분석 감도를 제한하는 요인입니다. 나노초 단위로 감쇠하기 때문에 마이크로초 또는 밀리초 범위의 시간 분해 형광 측정(시간 게이트)을 사용하면 자가 형광 신호가 소진된 후 란타나이드의 방출 신호를 감지할 수 있습니다. "짧은 수명" 형광 노이즈(배경 신호 및 산란된 여기 광)가 제거되고 시간 분해 형광(긴 수명) 신호는 매우 높은 감도로 측정할 수 있으며, 유일한 배경 신호는 비특이적으로 결합된 라벨입니다. 이는 정상 상태 형광 강도 검출과 비교할 때 배경 노이즈를 줄이고 감도를 높입니다.
여기 파장과 방출 파장 최대치(피크)의 차이를 스토크스 시프트라고 정의합니다. 시판되는 많은 정상 상태 형광체의 경우 이 폭이 상대적으로 좁고 흡수와 방출 스펙트럼이 겹쳐서 신호가 자체 소멸됩니다. 반대로 란탄화물은 스토크스 이동이 커서 시간 분해 형광 검출에서 신호 대 배경(S/B) 비율이 크게 증가합니다.
란탄화물은 "일반" 형광체보다 형광 강도가 높고 양자 수율이 높습니다. 이는 시간 분해 형광에서 분석 감도를 크게 향상시킵니다. 주목할 점은 높은 양자 수율로 인해 란타나이드는 공여체로는 완벽하지만 수용체로는 적합하지 않다는 점입니다.
제조업체에 따르면 시간 분해 형광 면역 분석은 해리/증강 단계 전에 중단하고 적절히 보관하면 최대 10년 동안 안정적입니다. 이를 되살리는 데 필요한 유일한 단계는 강화 용액을 추가하는 것입니다.
시간 분해 형광 측정의 단점
여러 단계
위에서 설명한 것처럼 킬레이트는 일반적으로 형광체를 안정화하거나 분자에 결합하거나 형광 특성을 향상시키는 기능을 가진 '케이지'에 란탄화물을 포함합니다. 시간 분해 형광 검출에서 이 마지막 단계는 란타나이드가 "자연" 상태일 경우 매우 낮은 방출 강도를 높이기 위해 필요합니다. 그러나 이러한 다양한 유형의 케이지 간 전환은 세척이나 용액 추가와 같은 여러 중간 단계가 필요하기 때문에 상당한 제한이 있습니다. 형광 강도 기반 분석의 경우 일반적으로 그렇지 않습니다.
더 민감하고 효율적이지만, 시간 분해 형광 검출은 형광 강도 방식에 비해 시약과 계측에 더 많은 비용이 필요합니다.
시간 분해 형광 측정의 함정
시간 분해 형광에 적합한 마이크로플레이트 사용
시간 분해 형광 분석은 일반적으로 웰의 상단에서 검출해야 하며 일반적으로 흰색 플레이트에서 실행됩니다. 시간 지연형 검출은 자가 형광을 제거하고 배경을 감소시키므로 흰색 플레이트가 유용합니다. 흰색 플레이트는 빛의 방출을 반사하고 강화하여 더 강력한 신호를 제공합니다. 강한 신호가 감지기를 포화시킬 수 있는 경우 검은색 플레이트를 사용하는 것이 좋습니다.
시간 분해 형광 세포 기반 분석의 경우, 흰색/검은색 벽과 투명한 바닥이 있는 플레이트의 바닥에서 검출하는 것이 좋습니다. 그러나 모든 투명한 바닥이 자외선 투과성이 있는 것은 아니므로 플라스틱은 340nm에서 빛을 흡수하여 여기광(일반적으로 337nm)을 현저히 감소시킬 수 있습니다. 시간분해 형광 분석을 실행하기 전에 마이크로플레이트의 사양을 확인하고 바닥이 UV 투명인 플레이트를 사용하는 것이 좋습니다. 자세한 내용은"마이크로 플레이트: 실제에서의 유용성" 블로그 게시물을 참조하세요.
앞서 설명한 것처럼 시간 분해 검출은 자가 형광을 제거합니다. 그러나 란타나이드 표지 시약 배양 후와 강화 용액을 추가하기 전의 세척 단계는 매우 중요하며 분석 품질에 영향을 미칠 수 있습니다. 이러한 단계는 결합되지 않은 표지 시약을 모두 제거하기 위해 매우 효율적이어야 합니다. 그렇지 않으면 분석에서 비특이적인 미결합 란타나이드 이온의 존재로 인해 높은 배경 신호가 생성됩니다.
DELFIA 분석의 경우, 인산염 기반 완충액보다 TRIS-HCl 기반 완충액을 선호해야 합니다. 한편으로 인산염 농도가 높으면 긴 배양 시간 동안 킬레이트에서 유로퓸이 해리될 가능성이 있습니다. 다른 한편으로, 최대 신호는 일반적으로 인산염 기반 완충액에서 삼염산 염소산염 기반에 비해 더 낮습니다.
낮은 pH는 잠재적으로 킬레이트에서 란타나이드 이온을 방출할 수 있습니다. 이는 염료의 무결성에 부정적인 영향을 미치고 시간 분해 형광 검출에서 비특이적 결합과 배경을 증가시킬 수 있습니다. 또한 란타나이드 킬레이트를 비활성화할 수 있으므로 시약에 EDTA가 포함되어 있는지 주의하세요.
란타나이드는 편광 방출이 없기 때문에 이방성/형광 편광 측정에 사용할 수 없습니다.[5]
DELFIA는 퍼킨 엘머의 등록 상표입니다.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series