
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Les microplaques sont disponibles dans différentes couleurs, matériaux, densités de puits et géométries. Découvrez le format le mieux adapté à vos applications.
Il s'agit d'équipements de laboratoire constitués d'une microplaque comportant plusieurs cavités (ou puits) utilisées comme de petits tubes d'échantillonnage. On les appelle également microplaques de microtitration ou multi-puits. Elles se présentent généralement sous la forme de 6, 12, 24, 48, 96, 384 ou 1536 puits, le format 96 puits étant le plus couramment utilisé. Selon la taille des puits, elles peuvent contenir des volumes d'échantillons allant du microlitre au millilitre.
Les microplaques facilitent la préparation, la manipulation, l'examen, le traitement et la gestion d'un grand nombre d'échantillons. Aujourd'hui, elles sont devenues la norme dans les sciences de la vie, la recherche pharmaceutique, les diagnostics cliniques et la recherche analytique. Les tests immuno-enzymatiques (ELISA) sont l'une de leurs applications les plus courantes. Cependant, leurs utilisations sont diverses et répandues dans les sciences de la vie, notamment pour le stockage, la filtration, la séparation et le mélange des échantillons, ainsi que pour la détection et la quantification de ceux-ci.

Les microplaques ont été créées en 1951 par le Dr Gyula Takátsy, microbiologiste hongrois, alors qu'une épidémie de grippe provoquait une pénurie de matériel de laboratoire (voir la figure 1). Ce dernier devait trouver des solutions peu coûteuses pour poursuivre ses tests cliniques. Il a remarqué que les tests étaient trop coûteux en grande quantité et qu'il était possible d'augmenter considérablement le rendement en disposant plusieurs échantillons les uns à côté des autres. Il a donc créé la première microplaque en assemblant à la main huit rangées de douze puits (8 × 12 = 96) et en les reliant par une boucle de fil de fer. Cette solution lui a permis de gagner du temps lors du pipetage.
Dans les années 1960, son invention a progressivement gagné en popularité et est devenue un équipement standard dans les laboratoires du monde entier pour les tests biomédicaux.
L'utilisation généralisée a été facilitée à la fin des années 1980 par l'introduction d'une version moulée. Cela a permis de réduire le prix unitaire et d'accroître la capacité de production. Au cours des années suivantes, les microplaques ont continué d'être améliorées et de nombreuses variantes ont été développées pour répondre aux besoins spécifiques de la communauté scientifique.
Dans les années 1990, la Société pour le screening biomoléculaire (SBS) a entrepris de normaliser les caractéristiques et les formes. Ces caractéristiques concernaient principalement le nombre, la forme et la taille des puits, ainsi que des propriétés telles que les dimensions générales et le matériau. En 2003, l'American National Standards Institute (ANSI) a proposé et publié un ensemble de caractéristiques normalisées comprenant le diamètre, la profondeur et l'espacement des puits, ainsi que les dimensions générales (127,76 mm × 85,48 mm).1
Cette normalisation a permis d'élargir l'utilisation des microplaques, notamment dans le cadre de l'automatisation des laboratoires et de la production d'instruments de laboratoire. La microplaque est ainsi devenue un support efficace pour la découverte de médicaments et la recherche en sciences de la vie, et a gagné en popularité. On estime qu'environ 125 millions d'unités ont été utilisées rien qu'en 2000.2
En 2010, la SBS et l'Association for Laboratory Automation (ALA) ont fusionné pour former la Society for Laboratory Automation and Screening (SLAS). Depuis lors, les normes relatives aux microplaques sont désignées sous le nom d'ANSI/SLAS.
Outre le nombre de puits, les microplaques sont disponibles dans différents matériaux et couleurs, et présentent des formes et des capacités de volume variées. Avec une telle variété d'options, il peut être difficile de choisir celle qui convient le mieux à un essai spécifique. Nous résumons ici les principales caractéristiques, en se concentrant sur les applications spectrophotométriques.
Bien qu'il existe de légères différences de taille et de position des puits entre les différents types de microplaques des différents fabricants, toutes les plaques de microtitration ont les mêmes dimensions. Les puits sont généralement disposés dans une matrice rectangulaire et se présentent sous la forme de 6, 12, 24, 48, 96, 384 ou 1536 puits (voir la figure 2). Un format de 3456 puits est également disponible, mais il est peu utilisé. Le volume de remplissage de chaque puits dépend de la disposition. Le format le plus utilisé est celui de 96 puits (jusqu'à 300 µL par puits). Les configurations à densité plus élevée sont généralement utilisées pour la miniaturisation. Outre le fait qu'ils permettent de traiter davantage d'échantillons, les formats 384 (jusqu'à 100 µL/puits), 1536 (jusqu'à 15 µL/puits) et 3456 (jusqu'à 5 µL/puits) réduisent les volumes de réactifs et, par conséquent, les coûts (voir le tableau 1).
Le volume de remplissage de chaque puits dépend de la disposition. Le format le plus utilisé est celui de 96 puits (jusqu'à 300 µL par puits). Les configurations à densité plus élevée sont généralement utilisées pour la miniaturisation. Outre le fait qu'ils permettent de traiter davantage d'échantillons, les formats 384 (jusqu'à 100 µL/puits), 1536 (jusqu'à 15 µL/puits) et 3456 (jusqu'à 5 µL/puits) réduisent les volumes de réactifs et, par conséquent, les coûts (voir le tableau 1).
En règle générale, un tiers du volume de remplissage maximum est le volume le plus bas recommandé pour un puits afin d'obtenir une mesure efficace et réaliste. Il ne faut donc pas descendre en dessous de 100 µL pour une plaque de microtitration standard à 96 puits.
Les microplaques à demi surface de 96 puits (jusqu'à 170 µL/puits) constituent une solution intermédiaire. Elles ont la même taille de puits que les microplaques à 384 puits, tout en conservant les dimensions extérieures et la position des puits d'une microplaque à 96 puits. Les puits sont donc plus petits et permettent de réduire jusqu'à 50 % le volume de l'échantillon. Ce format est généralement utilisé comme alternative aux microplaques de 384 puits lorsque de faibles volumes sont requis, mais que l'automatisation et le débit ne sont pas nécessaires.
Un concept similaire s'applique aux microplaques de 384 puits à faible volume ou à petit volume (parfois également appelées « high base »). Ces microplaques ont la même taille de puits qu'une microplaque de 1536 puits, tout en conservant les dimensions extérieures et la position des puits d'une microplaque de 384 puits. De même, les volumes d'échantillons peuvent être réduits de plus de 50 % par rapport à une microplaque standard de 384 puits. Outre le volume, la forme des puits est également affectée : alors que les microplaques de 384 puits ordinaires ont des puits carrés, les microplaques à faible volume ont des puits ronds.
Tableau 1 : Comparaison des différentes capacités de volume de remplissage de différents agencements.
| Nombre du puits | Volume recommandé |
| 6 | 2-5 ml |
| 12 | 2-4 ml |
| 24 | 0,5-3 ml |
| 48 | 0,5-1,5 ml |
| 96 | 100-300 µL |
| 96 demi-zone | 50-170 µL |
| 384 | 30-100 µL |
| 384 faible/petit volume | 5-25 µL |
| 1536 | 5-25 µL |
| 3456 | 1-5 µL |
En général, les formats à haute densité (1536 et 3456 puits) ne peuvent pas être pipetés manuellement et nécessitent l'utilisation d'une machine à pipeter. Le pipetage manuel est encore possible pour les microplaques de 384 puits, mais il est fastidieux et généralement déconseillé. Il faut donc évaluer si les coûts de manipulation plus élevés associés à l'utilisation de microplaques de 1536 ou 3456 puits sont compensés par les économies réalisées grâce à la miniaturisation. C'est le cas typique des installations de criblage à haut débit, mais pas de la plupart des laboratoires de sciences de la vie.
Les plaques ELISA comportent généralement 96 puits et sont composées de douze bandes de huit puits distinctes (voir la figure 3). Cette architecture simplifie l'utilisation partielle et la manipulation.
Les plaques de microtitration peuvent être fabriquées à partir de différents matériaux. Les plus couramment utilisés sont les polymères suivants : le polycarbonate, le polystyrène et la cyclooléfine. Le choix du polymère influence la transmission de la lumière, l'autofluorescence, l'absorption d'eau et l'échange de gaz, et par conséquent, l'utilisation, les applications et la qualité des essais.
En règle générale, le polystyrène est le matériau le plus utilisé pour le matériel de laboratoire en plastique. Sa transparence le rend idéal pour la détection optique, les essais d'absorbance (tels que l'ELISA) et la microscopie, avec une modification modérée. Toutefois, le polystyrène ne transmet pas la lumière ultraviolette (UV) inférieure à 320 nm et n'est donc pas adapté à la quantification de l'ARN et de l'ADN. Pour cette application, le copolymère de cyclooléfine (COC) présente une meilleure transmission de la lumière ultraviolette dans la plage 200-400 nm et une faible autofluorescence (voir la figure 4).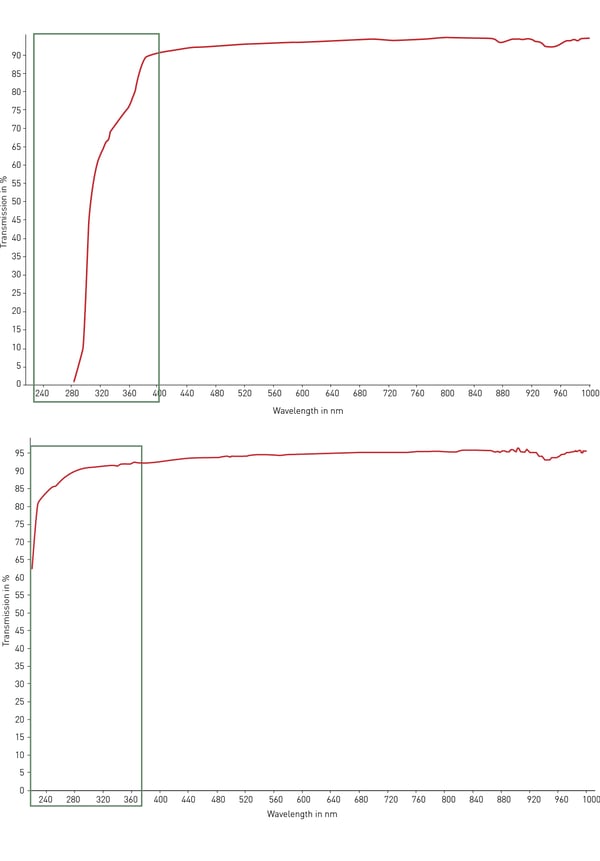 Pour les applications optiques et de microscopie, ainsi que pour le criblage à haut contenu, le verre et le quartz sont les matériaux les plus adaptés en raison de leur transparence, de leur faible autofluorescence et de leur capacité à transmettre la lumière. Toutefois, ces matériaux sont très coûteux, fragiles et ne sont pas jetables.
Pour les applications optiques et de microscopie, ainsi que pour le criblage à haut contenu, le verre et le quartz sont les matériaux les plus adaptés en raison de leur transparence, de leur faible autofluorescence et de leur capacité à transmettre la lumière. Toutefois, ces matériaux sont très coûteux, fragiles et ne sont pas jetables.
Outre les propriétés optiques, l'absorption d'eau et l'échange de gaz sont des paramètres importants dans les applications cellulaires. Les propriétés mécaniques influencent également la manipulation, en particulier par les systèmes automatisés. Les propriétés thermiques peuvent également être importantes dans les applications à haute température (par exemple, pour les microplaques de PCR) ou lorsque des scellants sont nécessaires.
Le polycarbonate et le polypropylène sont principalement utilisés pour les microplaques de PCR (voir la figure 5) et pour les échantillons soumis à de fortes variations de température (par exemple, pour le stockage à -80 °C). Outre la stabilité thermique, la résistance à de nombreux solvants et l'inertie biologique sont également requises pour le stockage.
Les microplaques sont généralement disponibles en quatre couleurs : transparent, noir, blanc et gris (voir la figure 6). En fonction du mode de détection utilisé, la couleur peut affecter le rapport signal/fond et la diaphonie entre puits lorsque des échantillons très lumineux ou très sombres sont adjacents. Un choix de couleur inadapté peut donc avoir un impact négatif sur vos données.
 Les microplaques claires (y compris transparentes aux UV) sont nécessaires pour les tests d'absorbance, car la lumière doit traverser l'échantillon dans ce mode de détection.
Les microplaques claires (y compris transparentes aux UV) sont nécessaires pour les tests d'absorbance, car la lumière doit traverser l'échantillon dans ce mode de détection.
Les microplaques noires, assombries par la présence de carbone, atténuent le signal de l'échantillon. En effet, la couleur noire absorbe une partie du signal lumineux émis par l'échantillon. Ces plaques sont donc bien adaptées aux essais d'intensité de la fluorescence, y compris de FRET, ainsi qu'aux essais de polarisation de fluorescence. Ces modes de détection ont généralement un fort rendement de signal et l'utilisation de la couleur noire permet de réduire le bruit de fond, l'auto-fluorescence et la diaphonie entre les puits, ce qui permet d'obtenir de meilleurs rapports signal/bruit.
Les microplaques noires ne sont généralement pas recommandées pour les tests de luminescence, de fluorescence résolue en temps (TRF ) et de TR-FRET, car le faible rendement de signal de ces modes de détection serait encore plus atténué par la couleur noire. Les microplaques blanches contenant du dioxyde de titane sont donc recommandées pour ces tests. La couleur blanche des puits reflète en effet partiellement le signal de l'échantillon, ce qui contribue à l'amplifier. L'inconvénient est que les microplaques blanches augmentent également le signal de fond. Toutefois, ce dernier est généralement assez faible dans les tests de luminescence. Dans le TRF, la fenêtre de mesure retardée élimine l'influence du fond.
Les microplaques grises constituent une solution intermédiaire entre les microplaques noires et blanches. Spécifiquement recommandées pour les techniques AlphaScreen® et AlphaLISA® car elles réduisent la diaphonie et le bruit de fond tout en fournissant de bons signaux.
Si vous souhaitez obtenir plus de détails sur l'influence de la couleur de la microplaque sur les résultats des mesures dans les différents modes de détection, ou si vous souhaitez consulter des données prouvant ces effets, veuillez vous reporter à publication 6 : « Comment choisir la meilleure couleur de microplaque pour mon test ».
Ces puits peuvent être circulaires ou carrés, ces derniers ayant des coins droits ou arrondis. Les puits carrés contiennent un volume d'échantillon plus important et augmentent la zone de transmission de la lumière par rapport aux puits ronds. Les puits ronds ont une surface totale plus petite et sont mieux adaptés à l'agitation. De plus, comme les puits ronds n'ont pas de paroi commune avec les puits adjacents, ils sont moins affectés par la diaphonie des signaux à travers la paroi en plastique du puits.
Ils se présentent également sous différentes formes : fond F, fond V, fond U et fond C (voir la figure 7). Les puits à fond plat (F) offrent la meilleure transmission de la lumière, sont idéaux pour les cultures de cellules adhérentes et conviennent aux tests de lecture du fond avec des lecteurs de microplaques ou des microscopes.
Les puits à fond V (conique) permettent de récupérer un volume maximal d'échantillons petits et précieux grâce à leur forme. Cependant, leur forme conique est désavantageuse pour les applications spectrophotométriques ou d'imagerie. Les puits en forme de V sont donc principalement utilisés pour le stockage des échantillons et le pipetage précis.
Les puits à fond arrondi (fond en U) facilitent le mélange, le lavage et le revêtement. Les puits à fond en U permettent un pipetage facile et sans résidus, et sont généralement utilisés pour les cellules en suspension et les sphéroïdes.
Les puits à fond incurvé (fond C) constituent un compromis entre les puits à fond F et les puits à fond U. Le fond plat permet d'utiliser ces puits pour des applications optiques. Le fond plat permet d'effectuer des mesures optiques, tandis que les bords arrondis facilitent le mélange et le lavage.

Les propriétés de surface du puits sont essentielles. C'est là que l'échantillon et le matériau du puits interagissent. Il existe en général trois types principaux de microplaques : non liantes ou faiblement liantes, moyennement liantes et fortement liantes. La liaison est affectée par les propriétés physiques du matériau et peut être modifiée par l'application de différents revêtements.
Pour les applications de spectroscopie biochimique et de criblage à haut débit, le polystyrène non revêtu est généralement le matériau de choix, car il est classé comme moyennement liant.
Les microplaques non liantes empêchent la fixation d'acides nucléiques, de protéines et de peptides à la surface du puits. Dans ce cas, un revêtement spécifique permet de diminuer le bruit de fond de l'essai et d'améliorer le rapport signal/bruit.
Les microplaques à forte liaison sont généralement utilisées pour les tests nécessitant l'immobilisation de molécules à la surface du puits. L'une des utilisations les plus connues est celle des tests ELISA. Dans ce cas, des revêtements et des traitements spécifiques introduisent un nombre défini de groupes hydrophiles afin de faciliter l'adsorption passive de biomolécules, telles que des anticorps. Les microplaques à liaison moyenne et élevée se distinguent généralement par le nombre de groupes polaires disponibles.
Un exemple illustrant l'impact du revêtement des microplaques sur les données biologiques a été démontré à l'aide d'un test d'activité du protéasome réalisé avec des microplaques non liantes, moyennement liantes et fortement liantes. Les chercheurs ont obtenu des résultats différents et ont montré que les performances de l'essai sur le protéasome dépendaient des propriétés des microplaques. L'activité du protéasome a été déterminée à l'aide d'un substrat fluorescent, la 7-amino-4-méthylcoumarine (AMC), marqueur largement utilisé à cette fin. Les spectres d'excitation et d'émission de l'AMC liée et non liée étant différents, l'AMC libre libéré par le clivage protéolytique a pu être facilement détecté à l'aide d'un lecteur de microplaques par fluorescence. Cependant, les courbes standard de l'AMC libre ont montré des différences significatives entre les trois types de microplaques. Comme prévu, la microplaque à forte liaison a donné le signal le plus faible. Il convient donc d'évaluer différentes microplaques afin de déterminer celle qui convient le mieux à l'essai ainsi que le rôle des éventuels effets spécifiques à la microplaque.4
Le revêtement de la microplaque peut également influencer la formation de ménisques à la surface du liquide, ce qui peut avoir un impact important sur les mesures basées sur l'absorbance, comme expliqué dans la publication : « Comment traiter la longueur du trajet et le ménisque dans les microplaques ».
Les microplaques ordinaires ne peuvent pas être utilisées pour la culture cellulaire et les tests cellulaires car elles sont généralement non stériles. Outre la stérilité, des traitements de surface hydrophiles spécifiques sont nécessaires pour permettre aux cellules de se fixer au fond du puits. Ces traitements hydrophiles sont généralement appelés « traités pour la culture de tissus » ou « traités pour la culture cellulaire ». Il existe également des revêtements à base de protéines de la matrice extracellulaire, comme le collagène, la fibronectine ou la laminine, ainsi que des revêtements synthétiques, comme la poly-lysine. Une surface répulsive est généralement requise pour les cellules en suspension, les organoïdes et les sphéroïdes.
Comme les tests cellulaires sont parfois réalisés sur plusieurs heures ou jours, l'évaporation des puits contenant les cellules peut potentiellement influencer les résultats et, en fin de compte, entraîner une diminution de la viabilité cellulaire. Certains fabricants proposent des microplaques comprenant une douve extérieure pouvant être remplie de liquide. Cela permet d'isoler les puits et d'empêcher l'évaporation, en particulier dans les puits situés en bordure, qui présentent un risque accru d'évaporation.
Lors de l'exécution de tests cellulaires, il est généralement recommandé de procéder à la détection à partir du fond du puits pour plusieurs raisons. Dans les microplaques blanches ou noires ordinaires, la lecture à partir du fond n'est pas possible et il faut utiliser des fonds transparents. Les parois des puits peuvent être blanches ou noires, en fonction de l'essai. Le fond transparent peut être constitué de différents matériaux, du plastique (polystyrène ou copolymère de cycloaléfine) au verre ou au quartz. Bien que la détection soit nettement meilleure avec le verre, et encore meilleure avec le quartz, ces matériaux sont beaucoup plus chers. De plus, les microplaques en verre et en quartz ne sont pas jetables et doivent être nettoyées et stérilisées à l'autoclave après chaque utilisation. Il faut donc décider si la meilleure performance, qui s'accompagne d'un coût plus élevé et d'une maintenance plus importante, justifie l'utilisation d'une telle microplaque par rapport à une microplaque jetable, moins chère, facile à utiliser et dotée d'un fond en plastique transparent.
Les lecteurs de microplaques détectent et quantifient les signaux lumineux émis par les échantillons liquides lors d'essais basés sur les microplaques. Ces instruments de laboratoire sont utilisés dans les sciences de la vie et l'industrie pharmaceutique pour quantifier les réactions chimiques, biologiques ou physiques. Outre les applications biologiques, cellulaires, biochimiques, pharmaceutiques et de découverte de médicaments, ils sont également utilisés dans la recherche environnementale ainsi que l'industrie alimentaire ou cosmétique.
Les lecteurs de microplaques se présentent sous la forme d'instruments monomodes ou multimodes capables de quantifier les échantillons selon différents modes tels que l'absorbance, l'intensité de fluorescence, la luminescence, la fluorescence résolue en temps, TR-FRET, la polarisation de fluorescence ou la technologie AlphaScreen. Selon leur méthode de sélection de la longueur d'onde, ils peuvent être basés sur un monochromateur ou sur un filtre.
Ils permettent d'améliorer l'efficacité des pratiques de laboratoire, de réduire les coûts des réactifs et de diminuer le temps de fonctionnement. Pour en savoir plus sur l'utilisation actuelle des lecteurs de microplaques, consultez notre base de données d'applications.
Malgré les normes ANSI/SLAS, les microplaques des différents fabricants présentent de légères variations en termes de dimensions et de position des puits. Ces variations peuvent influencer les données mesurées. Un petit décalage dans la profondeur ou la largeur de la position des puits sur une ligne de 24 ou 48 puits (pour une microplaque de 384 ou 1536 puits, respectivement) peut par exemple avoir pour conséquence que les mesures ne sont plus effectuées au centre du puits, mais sur la paroi en plastique entre deux échantillons.
C'est la raison pour laquelle les lecteurs BMG LABTECH sont livrés avec une base de données de sélection de microplaques comprenant plus de 50 configurations de microplaques différentes provenant de divers fabricants.
Outre les lecteurs de microplaques, d'autres instruments permettent de manipuler ou de gérer ces dernières. Ces instruments sont spécifiquement utilisés pour automatiser les laboratoires. On peut citer, par exemple, les manipulateurs de liquides et les laveurs qui servent à distribuer ou à retirer des liquides de différentes microplaques, les bras robotisés et les tapis roulants qui permettent de transporter les microplaques entre les instruments, les chargeurs de microplaques qui servent à les stocker pendant de courtes périodes, ainsi que les hôtels de microplaques ou les incubateurs qui permettent de les stocker sur le long terme. Les scelleurs et déscelleurs de microplaques, quant à eux, appliquent et retirent les films de scellement. Un exemple de manipulation automatisée est présenté dans la vidéo suivante :

Globalement, les lecteurs multimodes BMG LABTECH allient performances et miniaturisation des tests, compatibilité avec les options de manipulation automatisée, temps de mesure courts et économies de matériaux et d'autres ressources.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series