
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Améliorez la sensibilité des essais grâce à la fluorescence résolue en temps et réduisez le bruit de fond pour réaliser des tests immunologiques précis et des études d'interaction.
La fluorescence correspond à l'émission de lumière par une molécule lorsqu'elle est excitée par une lumière dont la longueur d'onde est plus courte que celle émise.
La détection de la fluorescence peut être divisée en deux types de mesures : la fluorescence à l'état stable et la fluorescence résolue en temps. La principale différence entre ces deux méthodes réside dans la nature et les propriétés des molécules fluorescentes (ou fluorophores) utilisées, ainsi que dans le temps de détection.
L'état stable est le mode de détection de la fluorescence le plus répandu, communément appelé « intensité de fluorescence ». Les fluorophores standard, comme la fluorescéine ou la rhodamine, émettent de la lumière à une longueur d'onde spécifique quelques nanosecondes après excitation. Ce laps de temps très court entre l'excitation et l'émission permet de détecter presque simultanément le signal d'émission fluorescente et l'excitation de l'échantillon.
Le second type, la fluorescence résolue en temps (TRF), est surveillé en fonction du temps lors de l'excitation. Contrairement à l'intensité de fluorescence à l'état stable, la fluorescence résolue en temps repose sur la détection des baisses d'intensité et/ou sur la détection retardée du signal d'émission lors de l'excitation. Dans les mesures de fluorescence résolue en temps, l'impulsion lumineuse d'excitation est plus courte que le temps de décroissance du signal fluorescent. La détection de la fluorescence résolue en temps n'est possible que lorsque le signal d'émission du fluorophore est prolongé jusqu'à la microseconde, voire la milliseconde, et qu'il n'est pas de courte durée, de l'ordre de la nanoseconde, comme c'est le cas pour les marqueurs courants (voir la figure 1).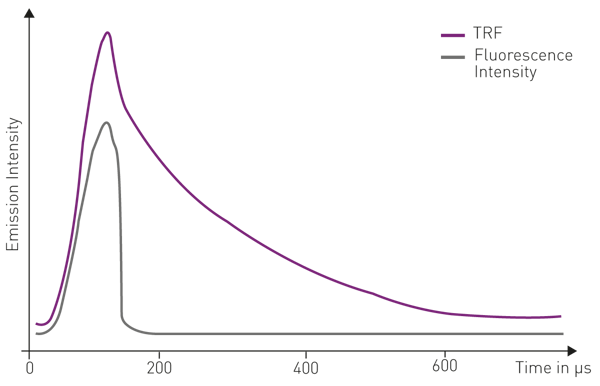
Les lanthanides (Ln) sont un groupe d'éléments chimiques métalliques fluorescents uniques, souvent appelés « éléments de terre rare ». Ils ont des coefficients d'absorption (excitation) très faibles et des taux d'émission lents. Cela se traduit par des temps de décroissance de la fluorescence prolongés, compris entre 0,5 et 3 millisecondes (longue durée de vie). Tous les lanthanides forment des cations trivalents (Ln³⁺) et émettent dans une solution aqueuse. En outre, leurs pics d'émission sont très nets et étroits, avec un important décalage de Stokes.1
Les lanthanides possèdent donc des propriétés favorables en tant que sondes biochimiques. À l'origine, ils ont été utilisés dans des systèmes biologiques comme sondes luminescentes pour le calcium. Il a en effet été démontré que la luminescence des lanthanides est un capteur sensible des sites de liaison du Ca2+ dans les protéines.2
Leur décroissance de fluorescence prolongée en fait des fluorophores idéaux pour les applications de fluorescence résolue en temps. Quatre d'entre eux, l'europium, le terbium, le samarium et le dysprosium, sont largement utilisés dans les sciences de la vie, notamment dans les tests immunologiques à fluorescence résolue en temps ; l'europium et le terbium sont les plus couramment utilisés (voir la figure 2).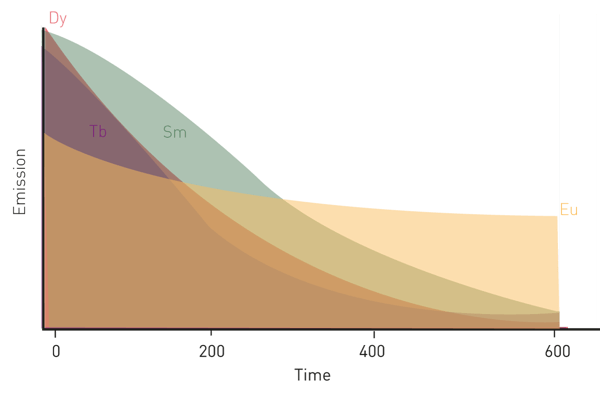
Les ions d'europium (Eu³⁺) sont notamment fréquemment utilisés comme marqueurs pour la détection de la fluorescence résolue en temps dans les essais immunologiques. Outre la fluorescence à longue émission, l'europium présente un grand décalage de Stokes (290 nm), un spectre d'émission très net à 615 nm (fig. 3) et un spectre d'excitation sans chevauchement avec le spectre d'émission.3
L'émission des lanthanides étant généralement trop faible pour les applications de fluorescence résolue en temps, ils ne sont pas excités directement, mais intégrés dans une sorte de « cage » collectrice de lumière. Cette « cage », le plus souvent un chélate ou un cryptate, permet à la fois de collecter et de transférer de l'énergie aux ions lanthanides, ce qui se traduit par des intensités d'émission plus élevées (voir la figure 4). Il convient de mentionner que le spectre d'excitation du complexe cage-lanthanide reflète le spectre d'absorption de la « cage » et non celui du lanthanide lui-même.4
Outre un signal d'émission plus élevé, la chélation permet de conjuguer les ions lanthanides à des composants biologiques (anticorps, récepteurs, ligands, etc.), ce qui est indispensable à plusieurs applications de fluorescence résolue en temps.
Le dispositif de mesure est similaire à celui utilisé pour la détection de l'intensité de la fluorescence : il se compose d'une source lumineuse, d'un dispositif optique permettant de sélectionner la longueur d'onde et d'un détecteur à tube photomultiplicateur (PMT).
Le complexe lanthanide-chélate-cryptate étant généralement excité à 337 nm, une lampe flash au xénon ou un laser spécifique est utilisé comme source lumineuse. Les lecteurs de microplaques multimodes sont équipés d'une lampe flash au xénon à large bande, car celle-ci offre une plus grande flexibilité pour les méthodes de détection multiples. Les lecteurs haut de gamme proposent en option un laser d'excitation de fluorescence résolue en temps. Ce laser concentre davantage d'énergie sur les longueurs d'onde d'excitation spécifiques des lanthanides, ce qui peut conduire à de meilleurs résultats avec une meilleure discrimination entre les signaux faibles et élevés. Toutefois, en raison de l'excitation importante à environ 337 nm, il s'agit d'une source lumineuse à usage unique qui ne peut pas être utilisée pour exciter d'autres méthodes de détection que la fluorescence résolue en temps.
En ce qui concerne la sélection de la longueur d'onde, les lecteurs de microplaques à filtre ou à monochromateur peuvent être utilisés pour la détection des essais de fluorescence résolue en temps. Les lecteurs à filtre sont généralement plus sensibles que les monochromateurs, car ils offrent une transmission lumineuse plus élevée. Ils sont donc recommandés pour les essais TRF dont le rendement en photons est limité. En règle générale, les essais de transfert d'énergie de fluorescence résolus en temps sont particulièrement difficiles pour les lecteurs à base de monochromateurs.
Des tubes photomultiplicateurs (PMT) sont utilisés comme détecteurs. En raison des propriétés d'émission longue des lanthanides, dans le cas de la fluorescence résolue en temps, le détecteur PMT est allumé après l'excitation. Cela permet au signal autofluorescent de courte durée de s'estomper. L'intensité du signal d'émission est ensuite intégrée en fonction du temps pour une fenêtre temporelle spécifique. Ces deux paramètres sont appelés « début d'intégration » et « temps d'intégration » et sont généralement de l'ordre de la microseconde (voir la figure 5).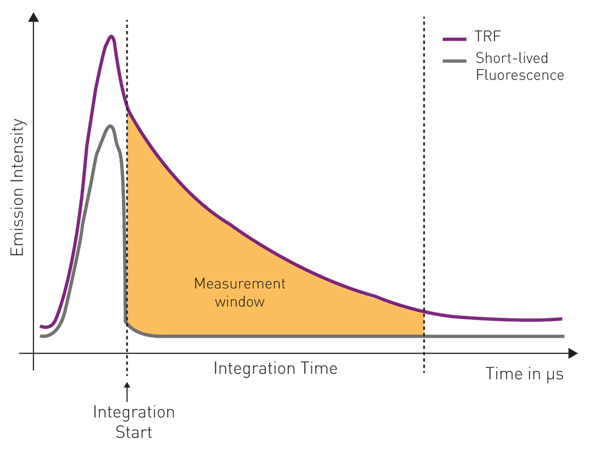
Les lecteurs de microplaques haut de gamme peuvent également être équipés de PMT à comptage de photons pour la fluorescence résolue en temps. Alors que les lecteurs de microplaques classiques fournissent simplement une valeur d'intégration de l'aire sous la courbe pendant le temps d'intégration, la fluorescence résolue en temps, qui utilise la détection par comptage de photons, permet de surveiller la courbe de désintégration complète du lanthanide.
Sur le lecteur PHERAstar FSX, la détection par comptage de photons permet de mesurer et d'afficher la courbe de décroissance de l'émission avec une résolution temporelle de 2 microsecondes. Cette fonction unique, appelée « Decay Curve Monitoring », simplifie le développement des essais de fluorescence résolue en temps. Elle aide à optimiser les paramètres de synchronisation, ce qui permet d'améliorer la détection du signal et de réduire le bruit de fond.
Ces immunodosages sont utilisés pour quantifier des molécules spécifiques, telles que des protéines ou des cytokines. Ils reposent sur la reconnaissance et la liaison de la cible par des anticorps spécifiques marqués par un fluorophore. L'analyse et la quantification du signal fluorescent fournissent des informations indirectes sur les molécules cibles. Ces immunodosages sont quantitatifs, très sensibles et permettent une détection multiparamétrique (ou multiplexage).
À l'instar des tests ELISA classiques, les immunodosages à fluorescence résolue en temps utilisent généralement un anticorps de capture fixé au fond du puits de la microplaque. Lorsque les échantillons sont incubés dans ces puits, l'anticorps capture la molécule cible sur la microplaque. Après élimination de l'échantillon non lié par lavage de la microplaque, un deuxième anticorps lié de manière covalente à un chélate de lanthane, le plus souvent d'europium, est ajouté. Celui-ci fixe la molécule cible, tandis que le second anticorps non lié est éliminé par lavage. La quantité d'anticorps marqué au lanthanide est proportionnelle à la concentration de la molécule cible dans l'échantillon. Les immunodosages par fluorescence résolue en temps peuvent être réalisés sous forme de dosages directs ou compétitifs.
Une étape de renforcement dissociatif est nécessaire pour libérer les molécules d'europium de leur « cage » sur l'anticorps pour trois raisons :
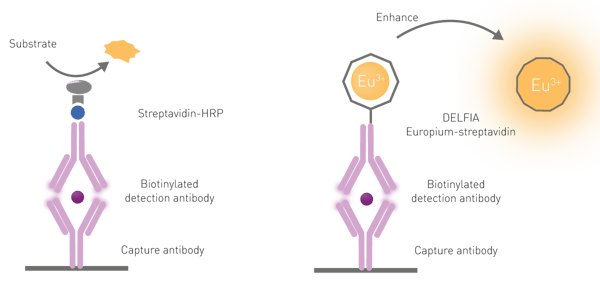 Les échantillons sont excités par une impulsion lumineuse à une longueur d'onde spécifique, généralement de 337 nm. La détection se fait en fonction du temps et de la décroissance du signal d'autofluorescence. La détection de la fluorescence résolue en temps ne commence donc qu'après l'épuisement du signal d'autofluorescence de courte durée (microsecondes). Le signal d'émission est intégré pendant une fenêtre temporelle spécifique et les données sont mesurées sous forme d'intensité intégrée, et non de décroissance temporelle. La quantité d'analyte étant proportionnelle au signal d'émission résolu en temps, elle peut être facilement quantifiée à l'aide d'une courbe standard.
Les échantillons sont excités par une impulsion lumineuse à une longueur d'onde spécifique, généralement de 337 nm. La détection se fait en fonction du temps et de la décroissance du signal d'autofluorescence. La détection de la fluorescence résolue en temps ne commence donc qu'après l'épuisement du signal d'autofluorescence de courte durée (microsecondes). Le signal d'émission est intégré pendant une fenêtre temporelle spécifique et les données sont mesurées sous forme d'intensité intégrée, et non de décroissance temporelle. La quantité d'analyte étant proportionnelle au signal d'émission résolu en temps, elle peut être facilement quantifiée à l'aide d'une courbe standard.
DELFIA® est l'un des tests immunologiques de fluorescence résolue en temps les plus couramment utilisés.
Le DELFIA (Dissociation-Enhanced Lanthanide Fluorescent Immunoassay) est un test de fluorescence résolue en temps, basé sur un lavage, dont le principe et le flux de travail sont similaires à ceux des ELISA. Il est censé pallier les limites typiques des tests ELISA en offrant une gamme dynamique plus large et des signaux stables pouvant être mesurés plusieurs mois après l'exécution du test. Pour effectuer des détections DELFIA, les lecteurs de microplaques doivent être équipés d'un dispositif de détection de fluorescence résolue en temps avec une excitation à 337 nm et une émission à 615 nm.
Dans les essais DELFIA, les anticorps de capture sont fixés à la microplaque. Après l'ajout de l'échantillon et d'une série d'étapes de lavage pour éliminer l'échantillon non lié, un anticorps de détection marqué à l'europium est ajouté. Enfin, une solution de renforcement est ajoutée après une dernière série de lavages. Comme indiqué précédemment, les tests DELFIA nécessitent une étape de renforcement dissociatif pour produire un signal fluorescent. Cette dissociation favorise la formation d'un nouveau chélate hautement fluorescent dans une solution micellaire stable. Un exemple d'essai immunologique DELFIA est présenté dans la publication intitulée : « Time-Resolved Fluorescence (TRF) immunoassay in 384-well format using a matched antibody pair kit and the PHERAstar FSX (Essai immunologique à fluorescence résolue en temps dans un format de 384 puits utilisant un kit de paires d'anticorps appariés et le PHERAstar FSX) ».
Bien que robustes et très sensibles, les tests DELFIA ne sont pas adaptés au criblage à haut débit, car la procédure implique des étapes de liaison, d'incubation et de lavage.
Il s'agit de vésicules extracellulaires d'origine endosomale contenant des acides nucléiques, des protéines et des lipides. Ils facilitent la communication entre différents types de cellules au sein d'un organisme. Les kits de détection d'exosomes par fluorescence résolue en temps TRIFic™ permettent de détecter la présence d'exosomes en se basant sur l'expression de protéines membranaires spécifiques.
Des sondes fluorescentes spécifiques, sensibles à l'oxygène et au pH, sont disponibles pour analyser les paramètres métaboliques cellulaires en mode de fluorescence résolue en temps. Dans des publications spécifiques, nous montrons comment la consommation d'oxygène intracellulaire et extracellulaire ainsi que l'activité glycolytique peuvent être déterminées en temps réel dans des cellules vivantes.
L'autre application la plus populaire de la fluorescence résolue en temps est probablement le TR-FRET ( transfert d'énergie de fluorescence résolue en temps). Cette technique est principalement utilisée dans le cadre de criblages de médicaments et de criblages à haut débit, car les essais de transfert d'énergie de fluorescence résolue en temps sont robustes, faciles à automatiser et à miniaturiser. Elle est principalement utilisée pour étudier les interactions protéine-protéine ou ligand-récepteur.
L'autofluorescence est émise par tous les échantillons biologiques et constitue généralement un facteur limitant la sensibilité de l'essai. Comme elle se désintègre en quelques nanosecondes, les mesures de fluorescence résolues en temps (time-gated) dans la gamme des micro- ou milli-secondes permettent de détecter le signal d'émission des lanthanides après l'épuisement du signal d'autofluorescence. Le bruit de fluorescence « à courte durée de vie » (signaux de fond et lumière d'excitation diffusée) est éliminé, et les signaux de fluorescence résolue en temps (à longue durée de vie) peuvent être mesurés avec une très grande sensibilité, le seul bruit de fond étant le marqueur lié de manière non spécifique. Cette méthode permet de réduire le bruit de fond et d'augmenter la sensibilité par rapport à la détection de l'intensité de la fluorescence à l'état stable.
La différence entre les maxima de longueur d'onde d'excitation et d'émission (pics) est appelée décalage de Stokes. Pour de nombreux fluorophores stables disponibles dans le commerce, ce décalage est relativement faible, ce qui entraîne un auto-éteignage du signal en raison du chevauchement entre les spectres d'absorption et d'émission. Au contraire, les lanthanides présentent des décalages de Stokes importants, ce qui augmente considérablement le rapport signal/bruit de fond (S/B) lors de la détection de la fluorescence résolue en temps.
Les lanthanides ont un rendement quantique élevé et une intensité de fluorescence supérieure à celle des fluorophores « ordinaires ». Cela améliore considérablement la sensibilité de l'essai en fluorescence résolue en temps. Il est à noter que le rendement quantique élevé des lanthanides en fait des donneurs parfaits, mais pas des accepteurs.
Selon les fabricants, si les immunodosages par fluorescence résolue en temps sont arrêtés avant l'étape de dissociation/renforcement et correctement stockés, ils sont stables pendant une période pouvant aller jusqu'à 10 ans. La seule étape nécessaire pour les réactiver est l'ajout de la solution de renforcement.
Comme nous l'avons vu précédemment, les chélates intègrent généralement les lanthanides dans des « cages » qui ont pour fonction de stabiliser le fluorophore, de le lier à une molécule ou d'améliorer ses propriétés fluorescentes. Dans la détection de fluorescence résolue en temps, cette dernière étape est nécessaire pour augmenter l'intensité d'émission, qui serait assez faible si les lanthanides étaient dans leur état « naturel ». Le passage entre ces différents types de cages présente toutefois une limitation importante, car de multiples étapes intermédiaires, telles que le lavage ou l'ajout de solutions, sont nécessaires. Ce n'est généralement pas le cas pour les essais basés sur l'intensité de fluorescence.
Bien que plus sensible et plus efficace, la détection par fluorescence résolue en temps nécessite des dépenses plus élevées en réactifs et en instruments que les méthodes basées sur l'intensité de fluorescence.
Les essais de fluorescence résolue en temps nécessitent généralement une détection depuis le haut du puits et sont généralement effectués dans des microplaques blanches. Comme la détection différée élimine l'autofluorescence et réduit le bruit de fond, l'utilisation de microplaques blanches est avantageuse. Elles réfléchissent et amplifient l'émission de lumière, ce qui permet d'obtenir des signaux plus puissants. Les microplaques noires sont conseillées lorsque le signal risque d'être trop fort pour le détecteur.
Pour les tests cellulaires, il est recommandé de procéder à la détection à partir du fond d'une microplaque à parois blanches ou noires et à fond transparent. Cependant, comme tous les fonds clairs ne sont pas transparents aux UV, le plastique peut absorber la lumière à 340 nm, ce qui réduit de manière significative la lumière d'excitation (généralement à 337 nm). Avant d'effectuer un test de fluorescence résolue en temps, il est donc conseillé de vérifier les spécifications de la microplaque et d'utiliser des microplaques dont le fond est transparent aux UV. Pour plus de détails, lisez notre article de blog : « La microplaque : son utilité dans la pratique ».
Comme indiqué précédemment, la détection résolue en temps permet d'éliminer l'autofluorescence. Cependant, les étapes de lavage après l'incubation avec les réactifs marqués au lanthanide et avant l'ajout de la solution de renforcement sont très importantes, car elles peuvent affecter la qualité de l'essai. Ces étapes doivent être très efficaces pour éliminer tous les réactifs marqués non liés. Si ce n'est pas le cas, l'essai produira un signal de fond élevé dû à la présence d'ions lanthanides non spécifiques et non liés.
Pour les essais DELFIA, il est préférable d'utiliser des tampons à base de TRIS-HCl plutôt que des tampons à base de phosphate. D'une part, des concentrations élevées en phosphate peuvent potentiellement dissocier l'europium de son chélate lors de longues périodes d'incubation. D'autre part, le signal maximal est généralement plus faible avec un tampon à base de phosphate qu'avec un tampon à base de TRIS-HCl.
Un pH faible peut en effet libérer l'ion lanthanide de son chélate. Cela peut avoir un effet négatif sur l'intégrité du colorant et augmenter la liaison non spécifique ainsi que le bruit de fond lors de la détection par fluorescence résolue en temps. Il faut également se méfier de la présence d'EDTA dans les réactifs, car il peut inactiver les chélates de lanthanide.
Comme les lanthanides n'émettent pas de lumière polarisée, ils ne peuvent pas être utilisés pour les mesures d'anisotropie/de polarisation de la fluorescence[5].
DELFIA est une marque déposée de Perkin Elmer, Inc.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series