
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Nutzen Sie die Fluoreszenzpolarisation für Bindungsstudien, Screening-Anwendungen sowie die Analyse molekularer Wechselwirkungen.
Die Fluoreszenzpolarisation (FP) ist eine auf Fluoreszenz basierende Nachweismethode, die häufig zur Überwachung molekularer Wechselwirkungen in Lösung verwendet wird. Im Gegensatz zur Fluoreszenzintensität, die sich auf die Quantifizierung der Emissionsintensität bei einer bestimmten Wellenlänge konzentriert und die Polarisation vernachlässigt, analysiert die Fluoreszenzpolarisation speziell die Emissionsintensität verschiedener Polarisationsebenen.
FP wird in der Regel verwendet, um biomolekulare Wechselwirkungen, wie beispielsweise die Bindung von Proteinen an Proteine oder Proteine an DNA, sowie die Aktivität von Enzymen zu bewerten. Sie kommt sowohl in der Grundlagenforschung als auch im Hochdurchsatz-Screening zum Einsatz.
Ursprünglich kam die Fluoreszenzpolarisation hauptsächlich im diagnostischen Bereich zum Einsatz. Ein FP-Immunoassay wurde erstmals in den 1960er Jahren beschrieben. In der biowissenschaftlichen Forschung waren die Anwendungen aufgrund des Mangels an empfindlichen Instrumenten zunächst begrenzt. Aktuell erfreut sich die FP in der biologischen Forschung großer Beliebtheit. Dies ist vor allem auf die höhere Leistung und Empfindlichkeit moderner Microplate Reader zurückzuführen, die robuste Ergebnisse mit minimaler Variabilität und größeren Assay-Fenstern liefern können.
Licht ist eine elektromagnetische Welle, deren elektrisches Feld senkrecht zur Ausbreitungsrichtung schwingt. Nicht polarisiertes Licht ist definiert als Licht, bei dem die Richtung der Oszillation des elektrischen Feldes mit der Zeit zufällig schwankt. Gängige Lichtquellen wie Sonnenlicht und klassische Glühlampen erzeugen solches unpolarisiertes Licht.
Durch einen bestimmten Filter kann die Ausrichtung des elektrischen Feldes von Licht auf eine Ebene beschränkt werden. In diesem Fall schwingen alle ausgewählten Lichtwellen in eine einzige Richtung und erzeugen so planes oder polarisiertes Licht. Die häufigste Quelle von polarisiertem Licht sind Laser. Unpolarisiertes Licht kann als Ansammlung von Lichtwellen in verschiedenen Ebenen betrachtet werden, ohne dass ein vorherrschender Polarisationszustand existiert (siehe Abb. 1).
Je nach Ausrichtung des elektrischen Feldes wird polarisiertes Licht in linear, zirkular und elliptisch unterteilt. Die lineare Polarisation, bei der sich das elektrische Feld auf eine einzige Ebene entlang der Ausbreitungsrichtung beschränkt, wird vorwiegend in biowissenschaftlichen Anwendungen verwendet und ist das Thema dieses Artikels. Für die Reflexion und Transmission von Licht sind die beiden wichtigsten linearen Polarisationszustände parallel und senkrecht zur Einfallsebene.
Die Fluoreszenzpolarisationsdetektion basiert auf der allgemeinen Theorie der stationären Fluoreszenzdetektion, die Sie auf der Seite zur Fluoreszenzintensität finden. Darüber hinaus beruht die Detektion auf zwei Beobachtungen: Zum einen ist der Polarisationsgrad eines Fluorophors umgekehrt proportional zu seiner Rotationsrate und zum anderen kann das von einem Fluorophor emittierte Licht auf verschiedenen Polarisationsebenen – typischerweise senkrecht und parallel zur Anregungsebene – unterschiedliche Intensitäten aufweisen.
Wenn plan polarisiertes Licht ein kleines (typischerweise < 1,5 kDA) und ungebundenes fluoreszierendes Molekül (den Tracer) anregt, emittiert dieses hauptsächlich unpolarisiertes Licht. Dies ist darauf zurückzuführen, dass ein kleines, freies Molekül in der Zeit zwischen Anregung und Emission in der Lösung schnell rotiert und dementsprechend Licht in verschiedenen Polarisationsebenen (unpolarisiert) emittiert.
Ist das kleine fluoreszierende Molekül dagegen an ein größeres Molekül (typischerweise > 10 kDA) gebunden, so verlangsamt dessen größeres Molekülvolumen die Rotation, was zur Emission von Licht führt das überwiegend in der gleichen Ebene wie das Licht der Anregungsquelle polarisiert ist (siehe Abb. 2).
Die Fluoreszenzpolarisation ist somit ein Maß für die Molekülrotation, die zwischen der Anregung und der Emission des Tracers stattfindet. Sie wird nach der folgenden Gleichung berechnet:
P = (F|| - F⊥)/(F|| + F⊥)
Quantitativ ist die Polarisation definiert als die Differenz zwischen der Emissionsfluoreszenzintensität parallel (F||) und senkrecht (F⊥) zur Anregungslichtebene, geteilt durch die Gesamtfluoreszenzemissionsintensität.¹
Da es sich um ein Verhältnis der Lichtintensitäten handelt, ist der Wert P eine dimensionslose Zahl. Er wird häufig in Millipolarisation (mP) ausgedrückt, wobei 1 P = 1000 mP entspricht. Obwohl P-Werte zwischen -330 und 500 mP möglich sind, werden diese theoretischen Grenzen nur selten erreicht. Bei bioanalytischen Anwendungen liegen die typischen Werte zwischen 10 und 300 mP (siehe z. B. Abbildung 3).
Der 1960 eingeführte Begriff Anisotropie wird häufig im Zusammenhang mit polarisierter Emission verwendet. Anisotropie (bezeichnet als A oder r) ist das Verhältnis der Emissionsintensitäten in der folgenden Gleichung:
r = (F|| - F⊥)/(F|| + 2 F⊥)
F|| gibt die Intensität nach vertikal polarisierter Anregung und vertikaler Polarisation des Emissionslichts an. F⊥ gibt die Intensität bei Verwendung eines vertikalen Polarisators für die Anregung und eines horizontalen Polarisators für die Emission an. 2
Fluoreszenzpolarisation und Anisotropie sind mathematisch verwandt und werden synonym verwendet. Sie werden beide aus den Emissionsintensitäten von polarisiertem und unpolarisiertem Licht abgeleitet und stellen einen Durchschnitt der gebundenen/ungebundenen Zustände eines fluoreszierenden Moleküls dar. Für die meisten Anwendungen sind die Informationsgehalte ihrer Funktionen identisch, da die Anisotropie keine zusätzlichen Informationen liefert.3
In der Regel hängt die Wahl des einen oder anderen Begriffs von praktischen Erwägungen und Gewohnheiten ab. Am häufigsten wird die Fluoreszenzpolarisation zur Beschreibung der gesamten Technologie und in der klinischen Chemie verwendet, während die Anisotropie eher in der Biophysik und Biochemie üblich ist.
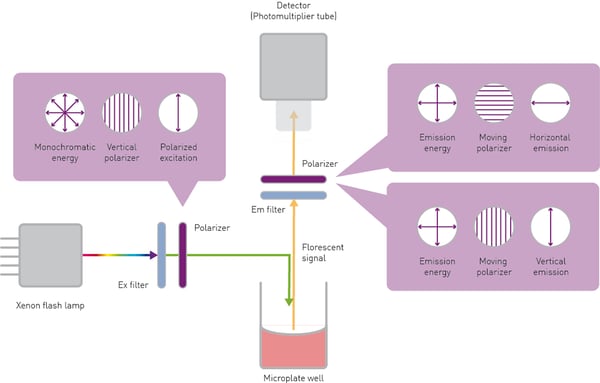
Die Fluoreszenzpolarisation kann mit einem Microplate Reader nachgewiesen werden. Das Verfahren und der Aufbau entsprechen dabei denen zur Bestimmung der Fluoreszenzintensität. Es gibt jedoch einige Unterschiede, die hauptsächlich mit der Auswahl der Polarisationsebenen zusammenhängen.
Die Probe wird durch vertikal (parallel) polarisiertes Licht einer bestimmten Wellenlänge angeregt. In der Regel dient eine Xenon- oder Halogenlampe als Anregungslichtquelle. Ihr weißes Licht wird entweder mit einem Filter oder einem Monochromator spektral gefiltert. Die Polarisationsebene wird durch einen speziellen Filter, den Polarisator, ausgewählt.
Der elektrische Feldvektor des natürlichen Lichts kann jede beliebige Schwingungsrichtung relativ zur Ausbreitungsrichtung annehmen. Polarisatoren sind optische Elemente – in der Regel dünne Filme –, die eine Richtung des elektrischen Vektors isolieren können. Der Anregungspolarisator befindet sich zwischen der Anregungsquelle und der Probe. Je nach Ausrichtung der vertikalen Ebene lässt er paralleles Licht zur Probe durch und blockiert senkrecht polarisiertes Licht.
Das von der Probe emittierte Licht wird entweder durch einen Filter oder einen Monochromator spektral gefiltert, um unerwünschte Wellenlängen zu entfernen. Darüber hinaus muss das emittierte Licht je nach seiner Ausrichtung zur Ebene des polarisierten Anregungslichts in parallele oder senkrechte Wellen aufgeteilt werden. Dies wird durch Emissionspolarisatoren im Lichtweg zwischen Probe und Detektor ermöglicht. Diese sind typischerweise vom gleichen Typ wie der Anregungspolarisator. Schließlich wird die Intensität der beiden polarisierten Ebenen mit einem Detektor, in der Regel einer Photomultiplier-Röhre (PMT), quantifiziert.
Die beiden Ebenen werden getrennt voneinander erfasst. Der einfachste Ansatz besteht darin, die parallele und die senkrechte Ebene mit zwei aufeinanderfolgenden Messungen zu erfassen. Dabei wird in der ersten Messung die parallele Polarisationsintensität erfasst und in der zweiten Messung der um 90° gedrehte Emissionspolarisator zur Erfassung der horizontalen (senkrechten) Ebene verwendet (siehe Abb. 4).
High-End-Fluoreszenz-Polarisations Microplate Reader wie der PHERAstarFSX können dank der Simultaneous Dual Emission-Detektionstechnologie die beiden Polarisationsebenen gleichzeitig erfassen. Dieser Ansatz spart Zeit und reduziert die Variabilität, die durch zwei aufeinanderfolgende Messungen entsteht.
Monochromatoren werden im Allgemeinen für die FP-Detektion nicht empfohlen, da sie eine geringe Lichtdurchlässigkeit und einen hohen Streulichtanteil aufweisen. Dies führt zu einer erhöhten Probenvariabilität, was sich negativ auf das Testfenster und die Robustheit des Tests auswirkt.
Für den Nachweis im UV-Bereich müssen die Lesegeräte mit einer Xenon-Lampe ausgestattet sein. Halogenlampen sind wegen ihrer geringen Emission unter 400 nm nicht zu empfehlen. Darüber hinaus sind spezielle UV-Polarisatoren erforderlich, da herkömmliche Polarisatoren in diesem Wellenlängenbereich eine schlechte Transmission aufweisen.
Niedrige Polarisationswerte (P) zeigen an, dass die fluoreszierenden Moleküle nicht gebunden sind, sondern sich frei in der Lösung bewegen. Hohe P-Werte deuten auf das Vorhandensein eines größeren Molekülkomplexes hin. Obwohl der Messbereich in bioanalytischen Anwendungen mit 10 bis 300 mP recht begrenzt erscheint, können mit High-End-Multimode Microplate Reader wie dem PHERAstar FSX oder dem CLARIOstar Plus sehr präzise Messungen mit Standardabweichungen von ±0,5 mP erzielt werden.
Die Wahl des Fluoreszenzfarbstoffs ist bei FP-Assays von entscheidender Bedeutung. Ihre Anregungs- und Emissionsspektren müssen sich von den Wellenlängen anderer, in der Lösung vorhandener Moleküle unterscheiden, um die Autofluoreszenz zu reduzieren. Zudem müssen sie eine große Stokes-Verschiebung aufweisen, um den negativen Einfluss der Lichtstreuung zu verringern. Die Fluorophore müssen sich leicht an den Tracer konjugieren lassen, ohne dessen Rotation zu stören oder die Wechselwirkung zu beeinträchtigen. Außerdem müssen sie eine hohe Quantenausbeute (d. h. eine hohe Intensität) aufweisen sowie chemisch und photostabil sein.⁴
Am häufigsten werden Fluoresceinisothiocyanat (FITC) und Farbstoffe mit ähnlichen Spektren verwendet. In jüngster Zeit haben jedoch rote Farbstoffe wie Cy3B und Cy5 an Popularität gewonnen, was durch die verbesserte Leistung moderner Microplate Reader begünstigt wird. Da ihre geringe Photonenausbeute aufgrund technischer Verbesserungen bei der Signaldetektion keine Einschränkung mehr darstellt, kann ihre Verwendung vorteilhaft sein, um durch Autofluoreszenz bedingte falsch-negative Ergebnisse, die üblicherweise im grünen und blauen Bereich emittieren, sowie falsch-positive Ergebnisse aufgrund von Lichtstreuung zu reduzieren.⁵
Unter den Ansätzen zur Untersuchung molekularer Bindungsereignisse ist die FP einzigartig. Da sie auf einer einzelnen Fluoreszenzmarkierung basiert, sind keine zusätzlichen Trennungsschritte erforderlich. Dementsprechend können im Vergleich zu herkömmlichen Methoden weniger und in der Regel kostengünstigere Reagenzien verwendet werden. Da die Probenintegrität nicht beeinträchtigt wird, können die Proben häufig wiederholt gemessen werden, sofern der pH-Wert, die Temperatur und die Viskosität konstant sind.
Die FP ermöglicht die direkte Überwachung des Verhältnisses zwischen freiem und gebundenem Tracer in einer Lösung in Echtzeit. Dadurch ist eine Gleichgewichtsanalyse mit sehr niedrigen Konzentrationen (typischerweise bis in den pikomolaren Bereich) möglich. Da es sich um ein Echtzeitverfahren handelt, sind die Experimente jedoch nicht auf das Gleichgewicht beschränkt und die Assoziations-/Dissoziationskinetik kann leicht analysiert werden.
FP ist ein homogenes Verfahren mit einem einfachen Mix-and-Read-Prinzip. Eine Trennung der zu messenden gebundenen und freien Spezies ist nicht erforderlich. Homogene Assays ermöglichen eine genauere Quantifizierung von Bindungsereignissen, da die Bindungsreaktion nicht durch zusätzliche Schritte gestört wird. Zu beachten ist jedoch, dass andere homogene Assays wie FRET, TR-FRET oder AlphaScreen®, neben der einmaligen Markierung des Tracers weitere Markierungsreaktionen erfordern.
Darüber hinaus eliminiert die ratiometrische Natur von FP den negativen Einfluss, den die Absorption oder das Quenching von Verbindungen auf die Datenerfassung haben können, und ermöglicht eine Miniaturisierung. All diese Gründe haben zur Einführung von FP-Assays im Hochdurchsatz-Screening geführt.
Dieses Messsystem hat trotz aller Vorteile auch einige Einschränkungen. So erfordert FP große Veränderungen des Molekülvolumens, um ein maximales Signal und ein ausreichendes Assay-Fenster zu erzeugen. Ein Fluoreszenzpolarisations-Bindungstest kann höchstens die Interaktion zwischen einem kleinen und einem großen Molekül überwachen und setzt die Markierung des kleinsten Interaktionspartners mit einem Fluorophor voraus. In der Regel werden daher kleine Proteine oder Peptide, Zytokine und chemische Verbindungen als Tracer verwendet. Dies gewährleistet den größtmöglichen Unterschied im Molekülvolumen bei der Bindung und somit das größtmögliche Assay-Fenster. Der FP-Bindungstest ist jedoch nicht geeignet, um die Interaktion zweier großer Proteine zu beobachten.
Außerdem können Autofluoreszenz und Lichtstreuungs-Artefakte verursachen. Daher ist es in der Regel empfehlenswert, den Fluoreszenzhintergrund eines Wells auf einer Mikroplatte vor Zugabe des Fluoreszenzfarbstoffs zu quantifizieren und von der Berechnung abzuziehen. Da die Autofluoreszenz bei höheren Wellenlängen in der Regel weniger ausgeprägt ist, können rote Farbstoffe wie BODIPY TMR oder Cy5 verwendet werden, um das Hintergrundrauschen zu minimieren⁶,⁷.
Der FP-Bindungstest eignet sich zur Analyse molekularer Interaktionen oder Dissoziationen bei Protein-Ligand- oder Peptid-Protein-Wechselwirkungen, Protein-DNA-Wechselwirkungen sowie präfibrillärer Proteinaggregation. Darüber hinaus können damit auch störende Verbindungen und unspezifische Inhibitoren identifiziert werden.
Weitere Anwendungen umfassen die Analyse der Membranfluidität in Liposomen und mitochondrialen Membranen sowie enzymatische Assays wie Proteolyse, RNA-Synthese, Bindungskinetik und Ubiquitin-Konjugation/Dekonjugation in Echtzeit (siehe Abb. 5). Anwendungen in Echtzeit für Ubiquitin können beispielsweise beim gezielten Proteinabbau für PROteolysis TArgeting Chimeras (PROTACs) oder Molecular Glues eingesetzt werden, einschließlich Untersuchungen ihrer Bindungsaktivität an ihre Ziele und der Kinetik der Wechselwirkungen. Mit FP-Bindungstests kann auch der gezielte Proteinabbau untersucht werden, der durch spezifische Wechselwirkungen zwischen bekannten Degronen und Ligasen entsteht.
In den 1990er Jahren wurde die FP in das Arzneimittel-Screening eingeführt, um den Prozess der Arzneimittelentdeckung zu erleichtern. Aufgrund ihres homogenen, schnellen und quantitativen Formats wird sie heute routinemäßig in Screening-Einrichtungen eingesetzt. Da die FP oft linear proportional zum Prozentsatz des gebundenen/freien Tracers ist, wird sie häufig zur Bestimmung der IC₅₀-Werte von Arzneimittelkandidaten eingesetzt.
Bei der Entdeckung von Arzneimitteln wurde sie zur Untersuchung verschiedener Targets, darunter GPCRs, Kinasen, Phosphatasen und Proteasen, eingesetzt. Während bei Interaktionsstudien in der Regel eine Zunahme des Molekülvolumens nachgewiesen wird, wird bei Dissoziations- und enzymatischen Abbautests in der Regel die Abnahme des Molekülvolumens als Messwert verwendet.
Die Hauptanwendungen von Fluoreszenzpolarisations-Assays im Hochdurchsatzverfahren (HTS) sind die Analyse direkter molekularer Wechselwirkungen sowie enzymatischer Reaktionen. Mithilfe schneller und empfindlicher Microplate Reader ist ein effizientes Screening kleiner Moleküle für eine wachsende Zahl pharmazeutisch relevanter Targets möglich. Beispiele hierfür sind das Screening von Inhibitoren des Ubiquitinierungsregulators und Anti-Krebs-Targets CSN5 sowie das Screening von H-Prostaglandin-D-Synthase-Inhibitoren.
Der Förster-Resonanz-Energie-Transfer (FRET) ist eine gängige Methode, um Interaktionsereignisse zu untersuchen. In der Regel werden die beiden mutmaßlichen Interaktionspartner mit zwei verschiedenen Fluorophoren (Donor und Akzeptor) markiert. FRET kann jedoch auch zwischen gleichen Fluorophoren stattfinden (homoFRET). FP kann auf homoFRET angewandt werden, da der Energietransfer eine Randomisierung der Emissionspolarisation bewirkt und ein depolarisiertes Signal erzeugt. Mithilfe von homoFRET-FP können Proteinakkumulationen oder Dimerisierungsereignisse in einer Zelle untersucht werden, wie in der Application Note "Monitoring of insulin granule packaging in live cells using homoFRET-FP detection" (Abb. 6) beschrieben.
Der Fluoreszenzpolarisations-Immunoassay (FPIA) wurde erstmals in der Biochemie eingesetzt. Es handelt sich um einen kompetitiven biochemischen Test, mit dem sich Antigene oder Antikörper nachweisen lassen. Dabei wird ein an ein Fluorophor gebundenes Antigen als Tracer verwendet. Dieses und ein zweites Antigen konkurrieren in der Regel um die Bindung eines ausgewählten Antikörpers. Eine hohe Tracer-Antikörper-Bindung führt in der Regel zu einem polarisierten Signal, während der freie Tracer ein unpolarisiertes Licht erzeugt, wenn das unmarkierte Antigen überwiegend vom Antikörper gebunden wird. Diese Veränderung ist proportional zur Menge des in der Probe vorhandenen Antigens.⁸
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows