
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Die zeitaufgelöste Fluoreszenz verbessert die Assay-Empfindlichkeit, indem sie das Hintergrundrauschen für präzise Immunoassays und Interaktionsstudien reduziert.
Fluoreszenz bezeichnet die Emission von Licht durch ein Molekül nachdem dieses durch Licht mit einer kürzeren Wellenlänge angeregt wurde.
Der Fluoreszenznachweis lässt sich im Wesentlichen in zwei Arten von Messungen unterteilen: stationäre (auch Steady-State genannt) und zeitaufgelöste Fluoreszenz. Der Hauptunterschied zwischen diesen beiden Methoden liegt in der Art und den Eigenschaften der verwendeten Fluoreszenzmoleküle (Fluorophore) sowie dem Zeitpunkt der Detektion.
Die stationäre Fluoreszenz ist die am weitesten verbreitete Nachweisart der Fluoreszenzdetektion und wird gemeinhin auch als "Fluoreszenzintensität" bezeichnet. Standard-Fluorophore (z. B. Fluorescein, Rhodamin usw.) emittieren bei Anregung innerhalb von Nanosekunden Licht mit einer bestimmten Wellenlänge. Diese sehr kurze Zeitspanne zwischen Anregung und Emission ermöglicht es, das fluoreszierende Emissionssignal fast zeitgleich mit der Anregung der Probe zu erfassen.
Bei der zeitaufgelösten Fluoreszenz (TRF), wird das Emissionssignal eines Fluorophors dagegen erst nach einer definierten Zeitspanne nach der Anregung aufgenommen. Im Gegensatz zur stationären Fluoreszenzintensität beruht die zeitaufgelöste Fluoreszenz auf dem Nachweis von Intensitätsabfällen und/oder auf dem verzögerten Nachweis des Emissionssignals nach der Anregung. Bei zeitaufgelösten Fluoreszenzmessungen ist der Anregungslichtpuls kürzer als die Abklingzeit des Fluoreszenzsignals. Ein zeitaufgelöster Fluoreszenznachweis ist nur möglich, wenn das Emissionssignal des Fluorophors bis in den Mikro- oder sogar Millisekundenbereich hinein verlängert wird und nicht wie bei herkömmlichen Fluorophoren innerhalb von Nanosekunden abklingt (siehe Abb. 1).
Lanthanoide: Spezielle Fluorophore für zeitaufgelöste Fluoreszenz
Lanthanoide (Ln) sind eine Gruppe einzigartig fluoreszierender metallischer chemischer Elemente, die häufig unter dem Begriff "Seltene Erden" zusammengefasst werden. Lanthanoide haben sehr niedrige Absorptionskoeffizienten (Anregungswerte) und langsame Emissionsraten. Dies führt zu langen Fluoreszenzabklingzeiten von 0.5 und 3 Millisekunden (lange Lebensdauer). Alle Lanthanoide bilden dreiwertige Kationen (Ln3+) und emittieren in wässriger Lösung. Außerdem verlaufen ihre Emissionsspitzen sehr steil und schmal mit einer großen Stokes-Verschiebung[1].
Lanthanoide besitzen vorteilhafte Eigenschaften als biochemische Sonden. Ursprünglich wurden sie in biologischen Systemen als Lumineszenzsonden für Calcium eingesetzt. Tatsächlich hat sich die Lumineszenz der Lanthanoide als empfindlicher Sensor für Ca²⁺-Bindungsstellen in Proteinen erwiesen.²
Der langsame Abfall ihres Fluoreszenzsignals macht Lanthanoide zu idealen Fluorophoren für zeitaufgelöste Fluoreszenzanwendungen. Vier von ihnen – Europium, Terbium, Samarium und Dysprosium – haben in den Biowissenschaften weite Verbreitung gefunden, insbesondere in zeitaufgelösten Immunoassays. Am häufigsten werden dabei Europium und Terbium verwendet (siehe Abbildung 2).
Insbesondere Europium-Ionen (Eu³⁺) werden häufig als Marker für die zeitaufgelöste Fluoreszenzdetektion in immunologischen Assays verwendet. Neben der lang emittierenden Fluoreszenz zeigt Europium eine große Stokes-Verschiebung von 290 nm ohne Überlappung zwischen Anregungs- und Emissionsspektrum. Bei einer Bandbreite von nur 10 nm weist es ein sehr scharfes Emissionsspektrum bei 615 nm auf (siehe Abb. 3).[3]
Da die Emission von Lanthanoiden für zeitaufgelöste Fluoreszenzanwendungen oft zu schwach ist, werden sie in der Regel nicht direkt angeregt, sondern in einen sogenannten lichtsammelnden „Käfig” eingebettet. Dieser Käfig, in der Regel ein Chelat oder ein Kryptat, ermöglicht sowohl das Sammeln von Energie als auch die Energieübertragung auf die Lanthanoid-Ionen. Dadurch werden höhere Emissionsintensitäten erreicht (siehe Abb. 4). Erwähnenswert ist, dass das Anregungsspektrum des Käfig-Lanthanoid-Komplexes das Absorptionsspektrum des „Käfigs” und nicht das des Lanthanoids selbst widerspiegelt [4].
Neben einem höheren Emissionssignal ermöglicht die Chelatbildung die Konjugation von Lanthanoid-Ionen an biologische Komponenten (z. B. Antikörper, Rezeptoren, Liganden usw.). Dies ist eine zwingende Voraussetzung für verschiedene zeitaufgelöste Fluoreszenzanwendungen.
Ähnlich wie beim Nachweis der Fluoreszenzintensität benötigen zeitaufgelöste Fluoreszenzmessungen eine Lichtquelle, ein optisches Gerät zur Auswahl der Messwellenlängen und einen Photomultiplier-Tube-Detektor (PMT).
Da der Lanthanoid-Chelat-Kryptat-Komplex typischerweise bei einer Wellenlänge von 337 nm angeregt wird, kommen für die zeitaufgelöste Fluoreszenzdetektion eine Xenon-Blitzlampe oder ein spezieller Laser als Lichtquelle zum Einsatz. Multi-Mode Microplate Reader sind für diesen Zweck mit einer Breitband-Xenon-Blitzlampe ausgestattet, da diese mehr Flexibilität für verschiedene Detektionsmethoden bietet. High-End-Reader können zusätzlich mit einem speziellen zeitaufgelösten Fluoreszenz-Anregungslaser ausgerüstet werden. Solche Laser können die Energie auf die spezifischen Anregungswellenlängen der Lanthanide fokussieren und so zu besseren Ergebnissen mit einer besseren Unterscheidung zwischen niedrigen und hohen Signalen beitragen. Aufgrund der scharfen Anregung bei etwa 337 nm handelt es sich jedoch nur um eine Lichtquelle für einen bestimmten Zweck, die sich nicht als Anregungsquelle für andere Nachweismethoden außer der zeitaufgelösten Fluoreszenz eignet.
Was die Wahl der Wellenlänge betrifft, können sowohl Filter-basierte als auch Monochromator-basierte Plattenlesegeräte für die Detektion von zeitaufgelösten Fluoreszenz-Assays eingesetzt werden. Da Filter-basierte Reader aufgrund ihrer höheren Lichtdurchlässigkeit in der Regel empfindlicher sind als Monochromator-basierte, werden sie für TRF-Assays mit begrenzter Photonenausbeute empfohlen. Zeitaufgelöste Fluoreszenz-Energie-Transfer-Assays sind dagegen eine besondere Herausforderung für Monochromator-basierte Lesegeräte.
Als Detektoren werden sogenannten Photomultiplier-Tubes (PMTs) verwendet. Da Lanthanoide lange emittieren, wird der PMT-Detektor bei der zeitaufgelösten Fluoreszenz versetzt zur Anregung eingeschaltet. Dadurch können kurzlebige Autofluoreszenzsignale ausgeblendet werden. Die Intensität des Emissionssignals wird dann als Funktion der Zeit für ein bestimmtes Zeitfenster integriert. Diese beiden Parameter werden als „Integrationsstart” und „Integrationszeit” bezeichnet und liegen normalerweise im Mikrosekundenbereich (siehe Abb. 5).
Hochwertige Microplate Reader können auch mit sogenannten photonenzählenden PMTs für eine zeitaufgelöste Fluoreszenzdetektion ausgestattet werden. Während Microplate Reader normalerweise lediglich einen Integrationswert für die Fläche unter der Kurve während der Integrationszeit liefern, überwacht die zeitaufgelöste Fluoreszenzdetektion mit Photonenzählung die gesamte Abklingkurve des Lanthanoids.
Beim PHERAstar FSX Microplate Reader ermöglicht die Photonenzählung die Messung und Anzeige der Emissionsabklingkurve mit einer zeitlichen Auflösung von zwei Mikrosekunden. Diese einzigartige Funktion, das so genannte Decay Curve Monitoring, vereinfacht die Entwicklung von zeitaufgelösten Fluoreszenz-Assays, hilft bei der Optimierung der Timing-Parameter und verbessert somit die Signalerkennung, während das Hintergrundrauschen reduziert wird.
Immunoassays, die auf zeitaufgelöster Fluoreszenz basieren, werden zur Quantifizierung spezifischer Moleküle, wie beispielsweise Proteine oder Zytokine, eingesetzt. Sie beruhen auf der Erkennung und Bindung der Zielmoleküle durch spezifische, mit einem Fluorophor markierte Antikörper. Die Analyse und Quantifizierung des Fluoreszenzsignals liefert indirekt Informationen über die Zielmoleküle. Immunoassays sind quantitativ, hochempfindlich und bieten die Möglichkeit der Multiparameter-Detektion (Multiplexing).
Ähnlich wie bei den klassischen ELISA-Tests wird bei zeitaufgelösten Fluoreszenz-Immunoassays in der Regel ein Capture-Antikörper verwendet, der an die Oberfläche von Mikroplatten-Wells gebunden ist. Während die Proben in diesen Wells inkubiert werden, bindet der Capture-Antikörper an das Zielmolekül und bindet dieses somit auf der Mikroplatte. Nachdem die ungebundene Probe durch Waschen der Mikroplatte entfernt wurde, wird ein zweiter Antikörper hinzugefügt, der kovalent an ein Lanthanoid-Chelat, meist Europium, gebunden ist. Dieser bindet das Zielmolekül, während der nicht gebundene zweite Antikörper weggewaschen wird. Die Menge des gebundenen Lanthanoid-markierten Antikörpers ist somit proportional zur Konzentration des Zielmoleküls in der Probe. Zeitaufgelöste Fluoreszenz-Immunoassays können als direkte oder kompetitive Assays durchgeführt werden.
Um die Europiummoleküle aus ihrem „Käfig” auf dem Antikörper zu befreien, ist ein dissoziativer Verstärkungsschritt aus drei Gründen erforderlich: Erstens weisen Lanthanoide eine schlechte Lichtabsorption auf, zweitens werden sie selten direkt angeregt und drittens fluoreszieren Lanthanoid-Chelate nur schwach, wenn sie an biologische Komponenten (in diesem Fall Antikörper) konjugiert sind. Die Dissoziation wird durch die Zugabe einer speziellen Lösung, die als „Anreicherungslösung” bezeichnet wird, gefördert. Neben der Dissoziation des Lanthanoids fördert die Lösung die Bildung eines neuen Chelat-„Käfigs”, der den für die Anregung des Lanthanoids erforderlichen Chromophor enthält. Der Chelat-Chromophor in der Enhancer-Lösung absorbiert das Anregungslicht und überträgt es auf das Lanthanoid, wodurch sich die Intensität des Emissionssignals deutlich erhöht (siehe Abb. 6).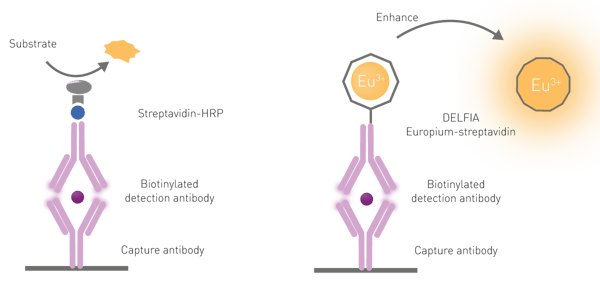
Die Proben werden durch einen Lichtimpuls mit einer bestimmten Wellenlänge – in der Regel 337 nm – angeregt. Der Nachweis erfolgt zeitgesteuert nach dem Abklingen des Autofluoreszenzsignals. Das bedeutet, dass die zeitaufgelöste Fluoreszenzdetektion erst nach Erschöpfung des kurzlebigen Autofluoreszenzsignals (Mikrosekunden) beginnt. Das detektierte Emissionssignal wird für ein bestimmtes Zeitfenster integriert und die Daten werden als integrierte Intensität gemessen. Da die Menge des Analyten proportional zum zeitaufgelösten Emissionssignal ist, kann sie mithilfe einer Standardkurve leicht quantifiziert werden.
Einer der am häufigsten verwendeten zeitaufgelösten Fluoreszenz-Immunoassays ist DELFIA®.
DELFIA (Dissociation-Enhanced Lanthanide Fluorescent Immunoassay) ist ein heterogener, zeitaufgelöster Fluoreszenz-Immunoassay, der dem Prinzip und Arbeitsablauf von ELISAs ähnelt. Er soll die typischen Einschränkungen von ELISA-Assays überwinden, indem er einen größeren dynamischen Bereich und stabile Signale bietet, die noch Monate nach der Durchführung des Assays gemessen werden können. Für die DELFIA-Detektion müssen die Plattenlesegeräte mit einer zeitaufgelösten Fluoreszenzdetektion bei einer Anregung von 337 nm und einer Emission von 615 nm ausgestattet sein.
Bei DELFIA-Assays werden die Capture-Antikörper an die Mikroplatte gebunden. Nach Zugabe der Probe und einer Reihe von Waschschritten, um die ungebundene Probe zu entfernen, wird ein mit Europium markierter Detektionsantikörper zugegeben. Nach einer abschließenden Reihe von Waschschritten wird eine Anreicherungslösung hinzugefügt. Wie bereits erwähnt, ist bei DELFIA-Tests ein dissoziativer Anreicherungsschritt erforderlich, um ein Fluoreszenzsignal zu erzeugen. Dieser Schritt fördert die Bildung eines neuen, stark fluoreszierenden Chelats in einer stabilen Mizellarlösung. Ein Beispiel für einen DELFIA-Immunoassay ist in der Application Note "Time-Resolved Fluorescence (TRF) immunoassay in 384-well format using a matched antibody pair kit and the PHERAstar FSX" dargestellt.
Obwohl DELFIA-Assays robust und sehr empfindlich sind, eignen sie sich nicht für ein Screening mit hohem Durchsatz, da das Verfahren umfangreiche Bindungs-, Inkubations- und Waschschritte umfasst.
Exosomen sind extrazelluläre Vesikel endosomalen Ursprungs, die Nukleinsäuren, Proteine und Lipide enthalten. Sie erleichtern die interzelluläre Kommunikation zwischen verschiedenen Zelltypen innerhalb eines Organismus. Die TRIFic™-Kits für die zeitaufgelöste, fluoreszenzbasierte Exosomendetektion weisen das Vorhandensein von Exosomen anhand der Expression spezifischer Membranproteine nach.
Für die Analyse zellulärer Stoffwechselparameter im zeitaufgelösten Fluoreszenzmodus stehen spezifische, sauerstoff- und pH-sensible fluoreszierende Sonden zur Verfügung. In speziellen Anwendungshinweisen zeigen wir, wie der intra- und extrazelluläre Sauerstoffverbrauch sowie die glykolytische Aktivität in lebenden Zellen in Echtzeit bestimmt werden können.
Die andere, wahrscheinlich populärste Anwendung der zeitaufgelösten Fluoreszenz ist TR-FRET (Time-Resolved Fluorescence Energy Transfer). TR-FRET-Assays sind robust und lassen sich leicht automatisieren und miniaturisieren, weshalb sie sich besonders gut für das Arzneimittel- und Hochdurchsatz-Screening eignen. Sie werden hauptsächlich zur Untersuchung von Protein-Protein- oder Liganden-Rezeptor-Interaktionen eingesetzt.
Autofluoreszenz wird von allen biologischen Proben emittiert und stellt in der Regel einen begrenzenden Faktor für die Empfindlichkeit des Assays dar. Da die Autofluoreszenz in Nanosekunden abklingt, ermöglichen zeitaufgelöste Fluoreszenzmessungen im Mikro- oder Millisekundenbereich den Nachweis des Emissionssignals der Lanthanoide, nachdem die Autofluoreszenz abgeklungen ist. Das „kurzlebige“ Fluoreszenzrauschen (Hintergrundsignale und gestreutes Anregungslicht) wird eliminiert und die zeitaufgelösten, langlebigen Fluoreszenzsignale können mit sehr hoher Empfindlichkeit gemessen werden. Dabei stellt die unspezifisch gebundene Markierung das einzige Hintergrundsignal dar. Dies reduziert das Hintergrundrauschen und erhöht die Empfindlichkeit im Vergleich zur Detektion der Fluoreszenzintensität im stationären Zustand.
Die Differenz zwischen den Maxima der Anregungs- und der Emissionswellenlänge (Peaks) wird als Stokes-Shift bezeichnet. Bei vielen handelsüblichen stationären Fluorophoren ist dieser relativ gering. Aufgrund der Überlappung von Absorptions- und Emissionsspektren führt dies zu einer Selbstabschwächung des Signals. Im Gegensatz dazu haben Lanthanoide einen großen Stokes-Shift, welche das Signal-zu-Hintergrund-Verhältnis (S/B) bei der zeitaufgelösten Fluoreszenzdetektion stark erhöht.
Lanthanoide haben eine hohe Quantenausbeute und eine höhere Fluoreszenzintensität als „normale” Fluorophore. Dadurch wird die Empfindlichkeit des Assays bei der zeitaufgelösten Fluoreszenz erheblich verbessert. Aufgrund ihrer hohen Quantenausbeute eignen sich Lanthanoide perfekt als Donor-, jedoch nicht als Akzeptor-Moleküle.
Wenn zeitaufgelöste Fluoreszenz-Immunoassays vor dem Dissoziations-/Verstärkungsschritt gestoppt und ordnungsgemäß gelagert werden, sind sie nach Herstellerangaben bis zu zehn Jahre lang stabil.
Wie bereits erwähnt, betten Chelate Lanthanoide in der Regel in „Käfige” ein. Diese haben die Aufgabe, das Fluorophor zu stabilisieren, es an ein Molekül zu binden oder seine Fluoreszenzeigenschaften zu verstärken. Bei der zeitaufgelösten Fluoreszenzdetektion ist dieser letzte Schritt erforderlich, um die Emissionsintensität zu erhöhen, die im „natürlichen” Zustand der Lanthanoide recht gering wäre. Der Wechsel zwischen diesen verschiedenen Arten von Käfigen stellt jedoch eine erhebliche Einschränkung dar, da mehrere Zwischenschritte, wie das Waschen oder die Zugabe von Lösungen, erforderlich sind. Dies ist bei Assays, die auf der Fluoreszenzintensität basieren, normalerweise nicht der Fall.
Obwohl die zeitaufgelöste Fluoreszenzdetektion empfindlicher und effizienter ist, erfordert sie im Vergleich zu Methoden, die auf der Fluoreszenzintensität basieren, höhere Ausgaben für Reagenzien und Geräte.
Zeitaufgelöste Fluoreszenz-Assays erfordern in der Regel eine Detektion von oberhalb des Mikroplatten-Wells und werden normalerweise in weißen Platten durchgeführt. Da die zeitverzögerte Detektion die Autofluoreszenz eliminiert und den Hintergrund reduziert, sind weiße Platten von Vorteil. Sie reflektieren und verstärken die Lichtemission, was zu stärkeren Signalen führt. Schwarze Platten werden hingegen empfohlen, wenn ein starkes Signal vorliegt das den Detektor sättigen könnte.
Für zeitaufgelöste, zellbasierte Fluoreszenz-Assays wird eine Detektion vom Boden einer Platte mit weißen/schwarzen Wänden und einem klaren Boden empfohlen. Da jedoch nicht alle durchsichtigen Böden UV-transparent sind, kann der Kunststoff Licht bei 340 nm absorbieren und somit das Anregungslicht (typischerweise bei 337 nm) erheblich reduzieren. Überprüfen Sie daher vor der Durchführung Ihres zeitaufgelösten Fluoreszenz-Assays die Spezifikationen Ihrer Mikroplatte und verwenden Sie Platten mit einem UV-transparenten Boden. Weitere Einzelheiten finden Sie in unserem Blogbeitrag "Die Mikroplatte: Nutzen in der Praxis".
Wie bereits erwähnt, wird bei der zeitaufgelösten Detektion die Autofluoreszenz eliminiert. Die Waschschritte nach der Inkubation mit Lanthanoid-markierten Reagenzien und vor der Zugabe der Anreicherungslösung sind jedoch sehr kritisch. Sie können die Qualität des Tests beeinträchtigen. Sie müssen daher sehr effizient sein, um alle ungebundenen markierten Reagenzien zu entfernen. Andernfalls erzeugt der Assay ein hohes Hintergrundsignal, das durch das Vorhandensein unspezifischer, ungebundener Lanthanoid-Ionen verursacht wird.
Für DELFIA-Assays sollten Puffer auf Tris-HCl-Basis gegenüber Puffern auf Phosphatbasis bevorzugt werden. Einerseits können hohe Phosphatkonzentrationen bei langen Inkubationszeiten Europium von seinem Chelat dissoziieren. Andererseits ist das maximale Signal bei Puffern auf Phosphat-Basis im Allgemeinen geringer als bei solchen auf Tris-HCl-Basis.
Ein niedriger pH-Wert kann dazu führen, dass das Lanthanoid-Ion aus seinem Chelat freigesetzt wird. Dies kann sich negativ auf die Integrität des Farbstoffs auswirken und die unspezifische Bindung sowie den Hintergrund bei der zeitaufgelösten Fluoreszenzdetektion erhöhen. Achten Sie außerdem auf das Vorhandensein von EDTA in Ihren Reagenzien, da es Lanthanoid-Chelate inaktivieren kann.
Da Lanthanoide keine polarisierte Lichtemission aufweisen, können sie nicht für Anisotropie-/ Fluoreszenzpolarisationsmessungen verwendet werden [5].
DELFIA ist eine eingetragene Marke von Perkin Elmer, Inc.
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series