
PHERAstar FSX
Powerful and most sensitive HTS plate reader


Utilisez la polarisation de fluorescence pour les études de liaison, les applications de criblage et l'analyse des interactions moléculaires.
La polarisation de fluorescence (PF) est une méthode de détection basée sur la fluorescence qui est largement utilisée pour surveiller les interactions moléculaires en solution. À la différence de l'intensité de fluorescence qui se concentre sur la quantification de l'intensité d'émission à une longueur d'onde spécifique en négligeant sa polarisation, la polarisation de fluorescence analyse spécifiquement l'intensité d'émission de différents plans de polarisation.
Elle est généralement utilisée pour évaluer les interactions biomoléculaires, telles que la liaison protéine-protéine ou protéine-ADN, ainsi que pour mesurer l'activité enzymatique. Elle est utilisée aussi bien dans la recherche fondamentale que dans le criblage à haut débit.
À l'origine, la polarisation de fluorescence était principalement utilisée dans le domaine du diagnostic. Le premier essai immunologique de polarisation de fluorescence a été décrit dans les années 1960. Dans le domaine des sciences de la vie, les applications ont d'abord été limitées en raison du manque d'instruments sensibles. Actuellement, la PF connaît une grande popularité dans la recherche biologique. Cette popularité est principalement due aux performances et à la sensibilité accrues des lecteurs de microplaques modernes, qui peuvent fournir des résultats robustes avec une variabilité minimale et des fenêtres d'essai plus larges.
La lumière est une onde électromagnétique dont le champ électrique oscille perpendiculairement à la direction de propagation. La lumière non polarisée est une lumière dont la direction d'oscillation du champ électrique fluctue aléatoirement dans le temps. Les sources de lumière courantes, telles que la lumière du soleil ou les ampoules incandescentes et halogènes classiques, produisent de la lumière non polarisée.
Si la direction du champ électrique est limitée à un plan par un filtre spécifique, toutes les ondes lumineuses sélectionnées oscilleront dans une seule direction, produisant ainsi de la lumière plane ou polarisée. Les lasers constituent la source la plus courante de lumière polarisée. La lumière non polarisée peut être considérée comme un ensemble d'ondes lumineuses polarisées sur différents plans, sans état de polarisation prédominant (voir la figure 1).
Selon l'orientation de son champ électrique, la lumière polarisée est classée en trois catégories : linéaire, circulaire ou elliptique. La polarisation linéaire, dont le champ électrique est limité à un seul plan le long de la direction de propagation, est principalement utilisée dans les applications des sciences de la vie et fait l'objet de cet article. Pour la réflexion et la transmission de la lumière, les deux états de polarisation linéaire les plus pertinents sont la polarisation parallèle et la polarisation perpendiculaire (par rapport au plan d'incidence).
La détection de la polarisation de fluorescence repose sur la théorie générale de la détection de la fluorescence à l'état stable, que vous trouverez sur la page consacrée à l'intensité de la fluorescence. Elle repose également sur le fait que le degré de polarisation d'un fluorophore est inversement lié à sa vitesse de culbutage, ainsi que sur l'observation que la lumière émise par un fluorophore peut avoir des intensités différentes selon les plans de polarisation, généralement perpendiculaires et parallèles au plan d'excitation.
Lorsqu'une lumière polarisée dans le plan excite une petite molécule fluorescente (typiquement inférieure à 1,5 kDa) non liée (le traceur), celle-ci émet principalement de la lumière non polarisée. Ceci est dû au fait qu'une petite molécule libre tourne rapidement dans la solution entre l'excitation et l'émission, et émet donc de la lumière sur différents plans de polarisation (non polarisée).
Inversement, si la petite molécule fluorescente est liée à une plus grande (typiquement > 10 kDa), son volume moléculaire accru ralentit sa rotation et entraîne l'émission d'une lumière principalement polarisée dans le même plan que la source d'excitation (voir la figure 2).
La polarisation de fluorescence correspond donc à la mesure de la quantité de rotation moléculaire survenant entre l'excitation et l'émission du traceur. Elle est calculée à l'aide de l'équation suivante :
P = (F|| - F⊥)/(F|| + F⊥).
Quantitativement, elle correspond à la différence entre l'intensité d'émission de fluorescence parallèle (F_(||)) et perpendiculaire (F_(⊥)) au plan de la lumière d'excitation, divisée par l'intensité totale d'émission de fluorescence.1
La valeur P est un nombre sans dimension, puisqu'il s'agit d'un rapport d'intensités lumineuses. Elle est souvent exprimée en millipolarisation (mP), où 1 P = 1 000 mP. Bien que P puisse prendre des valeurs comprises entre -330 et 500 mP, ces limites sont rarement atteintes dans la pratique. Dans les applications bioanalytiques, les valeurs typiques se situent entre 10 et 300 mP (voir la figure 3, par exemple).
Le terme « anisotropie » a été introduit en 1960 et est fréquemment utilisé dans le contexte de l'émission polarisée. L'anisotropie (notée A ou r) est le rapport des intensités d'émission dans l'équation suivante :
r = (F|| - F⊥)/(F|| + 2 F⊥)
F|| indique l'intensité après une excitation polarisée verticalement et une polarisation verticale de la lumière d'émission. F⊥ indique l'intensité lorsque l'on utilise un polariseur vertical pour l'excitation et un polariseur horizontal pour l'émission. 2
La polarisation et l'anisotropie de la fluorescence sont mathématiquement liées et utilisées de manière interchangeable. Elles sont toutes deux dérivées des intensités d'émission de la lumière polarisée et non polarisée, et représentent une moyenne des états liés et non liés d'une molécule fluorescente. Pour la plupart des applications, le contenu informatif de ces fonctions est identique, car l'anisotropie n'apporte aucune information supplémentaire.3
En général, le choix de l'un ou l'autre terme dépend de considérations pratiques et de l'habitude. La polarisation de fluorescence est le plus souvent utilisée pour décrire l'ensemble de la technologie et en chimie clinique, tandis que l'anisotropie est plus courante en biophysique et en biochimie.
La polarisation de fluorescence peut être détectée à l'aide d'un lecteur de microplaques, selon la même procédure et la même installation que l'intensité de la fluorescence. Il existe toutefois quelques différences, principalement liées à la sélection des plans de polarisation.
L'échantillon est excité à une longueur d'onde spécifique par une lumière polarisée verticalement (parallèlement). La source de lumière d'excitation est généralement une lampe au xénon ou une lampe halogène. Sa lumière blanche est filtrée spectralement à l'aide d'un filtre ou d'un monochromateur. Le plan de polarisation est sélectionné à l'aide d'un filtre spécifique appelé polariseur.
Le vecteur champ électrique de la lumière naturelle peut osciller dans n'importe quelle direction par rapport à la direction de propagation. Les polariseurs sont des éléments optiques, généralement des films minces, qui permettent d'isoler une direction du vecteur électrique. Le polariseur d'excitation est placé entre la source d'excitation et l'échantillon. Lorsque le plan est orienté verticalement, la lumière parallèle à l'échantillon est transmise et la lumière polarisée perpendiculaire est bloquée.
La lumière émise par l'échantillon est filtrée spectralement à l'aide d'un filtre ou d'un monochromateur afin d'éliminer les longueurs d'onde indésirables. En outre, la lumière émise doit être séparée en ondes parallèles ou perpendiculaires en fonction de son orientation par rapport au plan de la lumière d'excitation polarisée. Cela est possible grâce à des polariseurs d'émission, du même type que le polariseur d'excitation, placés sur le trajet de la lumière entre l'échantillon et le détecteur. Enfin, l'intensité des deux plans polarisés est quantifiée par un détecteur, généralement un tube photomultiplicateur (PMT).
Les deux plans sont détectés séparément. L'approche la plus simple consiste à effectuer deux mesures séquentielles pour détecter les plans parallèles et perpendiculaires. Après avoir détecté l'intensité de la polarisation parallèle lors de la première mesure, le polariseur d'émission est tourné de 90° pour détecter le plan horizontal (perpendiculaire) (voir la figure 4).
Les lecteurs de microplaques de polarisation de fluorescence , comme le PHERAstar FSX, peuvent acquérir les deux plans de polarisation simultanément grâce à la technologie de détection double émission simultanée. Cette approche permet de gagner du temps et de réduire la variabilité engendrée par deux mesures séquentielles.
En règle générale, les monochromateurs ne sont pas recommandés pour la détection de la polarisation de fluorescence, car ils présentent une faible transmission intrinsèque de la lumière et un bruit de fond important (lumière parasite). Ces facteurs augmentent la variabilité des échantillons, ce qui affecte négativement la reproductibilité et la robustesse de l'essai.
Pour la détection dans la gamme UV, les lecteurs doivent être équipés d'une lampe au xénon. Les lampes halogènes ne sont pas recommandées, car elles émettent peu de lumière en dessous de 400 nm. En outre, des polariseurs UV spécifiques sont nécessaires, car les polariseurs ordinaires ont une faible transmission dans les longueurs d'onde UV.
Des niveaux de polarisation faibles (P) indiquent que les molécules fluorescentes ne se sont pas liées et se déplacent librement dans la solution. Des niveaux élevés de P indiquent la présence d'un complexe moléculaire plus important. Bien que la plage de mesure dans les applications bioanalytiques, comprise entre 10 et 300 mP, puisse sembler assez restreinte, des mesures très précises, avec des écarts types de ± 0,5 mP, peuvent être réalisées avec des lecteurs de microplaques multimodes haut de gamme tels que le PHERAstar FSX ou le CLARIOstarPlus.
Le choix d'un colorant fluorescent pour ces tests est d'une importance capitale. Leur spectre d'excitation et d'émission doit différer de celui des autres molécules présentes dans la solution afin de réduire l'autofluorescence, et ils doivent présenter un grand décalage de Stokes pour limiter l'influence négative de la diffusion de la lumière. Ils doivent également être facilement conjugués au traceur sans perturber sa rotation ni interférer avec l'interaction. Ils doivent également présenter un rendement quantique élevé (c'est-à-dire une forte intensité), être chimiquement et photostables.4
Les fluorophores les plus couramment utilisés sont l'isothiocyanate de fluorescéine (FITC) et les colorants ayant des spectres similaires. Cependant, grâce à l'amélioration des performances des lecteurs de microplaques modernes, les colorants rouges tels que Cy3B et Cy5 sont de plus en plus utilisés. Étant donné que leur faible rendement photonique intrinsèque ne constitue plus une limitation grâce aux améliorations techniques apportées à la détection du signal, leur utilisation peut être avantageuse pour réduire les faux négatifs liés à l'autofluorescence, qui émet généralement dans les tons de vert et de bleu, ainsi que les faux positifs causés par la diffusion de la lumière.5
Parmi les approches utilisées pour étudier les événements de liaison moléculaire, la polarisation de fluorescence se distingue. Comme elle repose sur une stratégie de marquage fluorescent unique, des étapes de séparation supplémentaires ne sont pas nécessaires. Il est donc possible d'utiliser moins de réactifs, qui sont généralement moins coûteux que dans les méthodes conventionnelles. De plus, comme l'intégrité de l'échantillon n'est pas affectée, il est souvent possible de mesurer les échantillons de manière répétitive, à condition que le pH, la température et la viscosité restent constants.
La PF permet de contrôler directement le rapport libre/lié d'un traceur en solution, en temps réel, ce qui permet d'analyser des équilibres avec des concentrations très faibles (généralement de l'ordre du picomolaire). Cependant, en raison de sa nature en temps réel, les expériences ne sont pas limitées à l'équilibre et la cinétique d'association/dissociation peut être facilement analysée.
La PF est une technique homogène dont le protocole de mélange et de lecture est simple et ne nécessite pas de séparer les espèces liées et libres à mesurer. Les essais homogènes permettent une quantification plus précise des événements de liaison, car la réaction de liaison n'est pas perturbée par des étapes supplémentaires. Il est toutefois important de noter que d'autres tests homogènes, tels que le FRET, le TR-FRET ou l'AlphaScreen®, nécessitent d'autres réactions de marquage en plus du marquage unique du traceur.
De plus, la nature ratiométrique de la PF élimine l'influence négative que l'absorbance ou la turbidité du composé peuvent avoir sur l'acquisition des données, ce qui permet la miniaturisation. Toutes ces raisons ont conduit à l'adoption de la PF pour le criblage à haut débit.
Malgré tous ses avantages, ce système de mesure présente toutefois certaines limites. La polarisation de fluorescence requiert d'importantes modifications du volume moléculaire pour générer un signal maximal et une fenêtre d'essai. Au mieux, un essai de liaison par polarisation de fluorescence permet de surveiller l'interaction entre une petite et une grande molécule, mais nécessite le marquage du plus petit partenaire avec un fluorophore. Les traceurs sont donc généralement de petites protéines ou peptides, des cytokines et des composés chimiques. Cela garantit en effet la plus grande différence possible de volume moléculaire lors de la liaison, et donc la plus grande fenêtre d'essai possible. L'essai de liaison FP n'est donc pas adapté à l'observation de l'interaction entre deux grandes protéines.
En outre, l'autofluorescence des composés et la diffusion de la lumière peuvent provoquer des artefacts. Il est donc généralement recommandé de quantifier le fond de fluorescence d'un puits avant d'ajouter le colorant fluorescent et de le soustraire au calcul. Comme l'autofluorescence est généralement moins prononcée à des longueurs d'onde élevées, l'utilisation de colorants rouges tels que BODIPY TMR ou Cy5 permet de minimiser le bruit de fond.6, 7
Ce test permet d'analyser les événements d'interaction ou de dissociation moléculaire dans les interactions protéine-ligand ou peptide-protéine, les interactions protéine-ADN, ainsi que l'agrégation des protéines préfibrillaires. Il permet également d'identifier les composés interférents et les inhibiteurs non spécifiques.
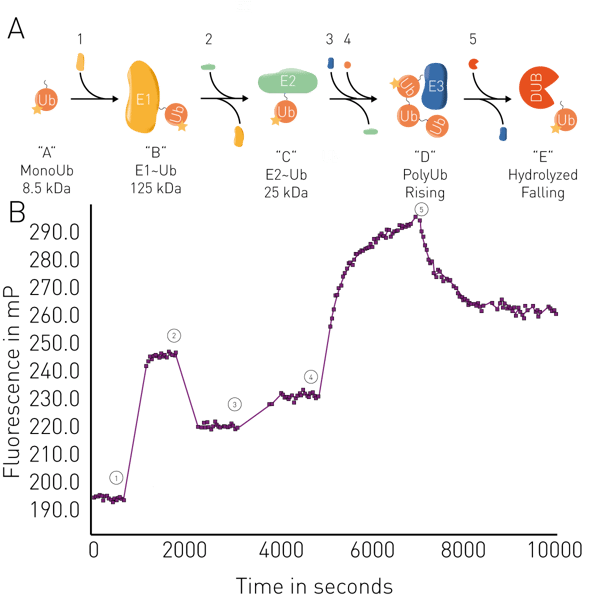
D'autres applications comprennent l'analyse de la fluidité membranaire dans les liposomes et les membranes mitochondriales, ainsi que des essais enzymatiques tels que la protéolyse, la synthèse de l'ARN, la cinétique de liaison et la conjugaison/déconjugaison de l'ubiquitine en temps réel (voir la fig. 5). Les applications en temps réel de l'ubiquitine peuvent par exemple être utilisées dans le cadre de la dégradation ciblée des protéines pour les PROteolysis TArgeting Chimeras (PROTACs) ou les colles moléculaires, y compris pour étudier leur activité de liaison à leurs cibles et la cinétique des interactions. Les tests de liaison par PF peuvent également être utilisés pour étudier la dégradation ciblée des protéines résultant d'interactions spécifiques entre des dégrons et des ligases connus.
Dans les années 1990, la polarisation de fluorescence a été adoptée dans le cadre du criblage de médicaments afin de faciliter le processus de découverte de traitements. Aujourd'hui, elle est couramment utilisée dans les installations de criblage en raison de son format homogène, rapide et quantitatif. Comme la PF est souvent linéairement proportionnelle au pourcentage de traceur lié/libre, elle est fréquemment utilisée pour déterminer les valeurs IC50 des médicaments candidats.
Dans le cadre de la découverte de médicaments, elle a notamment servi à étudier différentes cibles telles que les récepteurs couplés aux protéines G (RCPG), les kinases, les phosphatases et les protéases. Dans les études d'interaction, la PF détecte généralement une augmentation du volume moléculaire, tandis que dans les essais de dissociation et de dégradation enzymatique, c'est la diminution du volume moléculaire qui est utilisée comme indicateur.
Les principales applications des essais de polarisation de fluorescence dans le domaine des technologies de pointe sont l'analyse des interactions moléculaires directes et des réactions enzymatiques. Des lecteurs de microplaques rapides et sensibles permettent ici le criblage efficace de petites molécules pour une gamme croissante de classes de cibles. Les exemples incluent le criblage d'inhibiteurs du régulateur d'ubiquitination et de la cible anticancéreuse CSN5, ainsi que le criblage d'inhibiteurs de la H-prostaglandine D-synthase.
Le transfert d'énergie par résonance de Förster (FRET) est une méthode courante permettant d'étudier les interactions. En règle générale, les deux partenaires d'interaction supposés sont marqués avec deux fluorophores différents (un donneur et un accepteur). Cependant, le FRET peut également avoir lieu entre des fluorophores similaires (HomoFRET). La PF peut être appliquée à l'HomoFRET, car le transfert d'énergie entraîne une randomisation de la polarisation de l'émission, produisant ainsi un signal dépolarisé. L'HomoFRET-FP peut être utilisé pour étudier l'accumulation de protéines ou les événements de dimérisation dans une cellule, comme décrit dans la publication : « Monitoring of insulin granule packaging in live cells using homoFRET-FP detection » (voir la figure 6).
Le FPIA (dosage immunologique par polarisation de fluorescence) est le premier test biochimique à avoir été appliqué. Il s'agit d'un test biochimique compétitif permettant de détecter des antigènes ou des anticorps. Dans ce test, un antigène lié à un fluorophore est utilisé comme traceur. Ce dernier et un second antigène sont généralement en compétition pour lier un anticorps sélectionné. Une forte liaison entre le traceur et l'anticorps entraîne généralement un signal polarisé, tandis qu'une liaison importante entre l'antigène non marqué et l'anticorps provoque la production d'une lumière non polarisée par le traceur libre. Ce changement est proportionnel à la quantité d'antigène présente dans l'échantillon.8
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows